
题目列表(包括答案和解析)
下列叙述正确的是( )
A.聚丙烯的结构简式为:![]()
B.HCl的电子式为:![]()
C.NH3的结构式为:![]()
D.Ar原子的结构示意图为: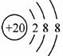
(12分)聚丙烯酰胺主要用于水的净化处理、纸浆的加工等。丙烯酰胺是一种不饱和酰胺,是生产聚丙烯酰胺的原料。其结构简式为:
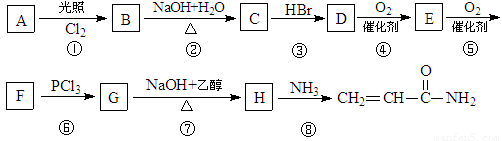
丙烯酰胺可由化合物A(分子式C3H6)经几步反应制得,反应过程如下:
已知:(1)3RCOOH + PCl33RCOCl+ H3PO3
(2)RCOCl + NH3RCONH2+ HCl
请根据以上信息回答下列问题:
(1)关于丙烯酰胺的下列叙述中正确的是:
A.能使酸性KMnO4溶液褪色;
B.能发生加聚反应生成高分子化合物;
C.与α—氨基丙酸互为同分异构体;
D.能与H2发生加成反应
(2)写出DE的反应方程式:
(3)GH(或者说反应③、⑦)的目的是
上述反应过程中属于取代反应的是:
(4)丙烯酰胺有多种同分异构体,同时符合下列要求的同分异构体有多种,试写出2种:
①链状,无碳碳叁键;
②同一个碳原子上不能同时连有-NH2和-OH或双键和-NH2(-OH);
③同一个碳原子上不能连有2个双键。
(12分)聚丙烯酰胺主要用于水的净化处理、纸浆的加工等。丙烯酰胺是一种不饱和酰胺,是生产聚丙烯酰胺的原料。其结构简式为:

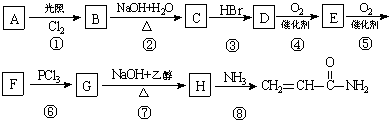
丙烯酰胺可由化合物A(分子式C3H6)经几步反应制得,反应过程如下:
已知:(1)3RCOOH + PCl33RCOCl + H3PO3
(2)RCOCl + NH3RCONH2 + HCl
请根据以上信息回答下列问题:
(1)关于丙烯酰胺的下列叙述中正确的是:
A.能使酸性KMnO4溶液褪色;
B.能发生加聚反应生成高分子化合物;
C.与α—氨基丙酸互为同分异构体;
D.能与H2发生加成反应
(2)写出DE的反应方程式:
(3)GH(或者说反应③、⑦)的目的是
上述反应过程中属于取代反应的是:
(4)丙烯酰胺有多种同分异构体,同时符合下列要求的同分异构体有多种,试写出2种:
①链状,无碳碳叁键;
②同一个碳原子上不能同时连有-NH2和-OH或双键和-NH2(-OH);
③同一个碳原子上不能连有2个双键。
聚丙烯酰胺主要用于水的净化处理、纸浆的加工等。丙烯酰胺是一种不饱和酰胺,是生产聚丙烯酰胺的原料。其结构简式为:![]() 。
。
丙烯酰胺可由化合物A(分子式C3H6)经如下几步反应合成,其合成流程如下:
已知: (1)3RCOOH+PCl3![]() 3RCOCl+H3PO3
3RCOCl+H3PO3
(2)RCOCl+NH3![]() RCONH2+HCl
RCONH2+HCl
试回答下列问题:
(1)关于丙烯酰胺的下列叙述中正确的是(填写代码) 。
A.能使酸性KMnO4溶液褪色 B.能发生加聚反应生成高分子化合物
C.与α―氨基乙酸互为同系物 D.能与H2发生加成反应
(2)写出D![]() E的反应方程式:
E的反应方程式:
(3)上述反应过程中属于取代反应的是(填写代码) 。
(4)丙烯酰胺在一定条件下能发生水解反应,试写出其在NaOH溶液中水解的化学方程式:
聚丙烯酰胺主要用于水的净化处理、纸浆的加工等。丙烯酰胺是一种不饱和酰胺,是生产聚丙烯酰胺的原料。其结构简式为:![]() 。
。
丙烯酰胺可由化合物A(分子式C3H6)经如下几步反应合成,其合成流程如下:

已知: (1)3RCOOH+PCl3![]() 3RCOCl+H3PO3
3RCOCl+H3PO3
(2)RCOCl+NH3![]() RCONH2+HCl
RCONH2+HCl
试回答下列问题:
(1)关于丙烯酰胺的下列叙述中正确的是(填写代码) 。
A.能使酸性KMnO4溶液褪色 B.能发生加聚反应生成高分子化合物
C.与α―氨基乙酸互为同系物 D.能与H2发生加成反应
(2)写出D![]() E的反应方程式:
E的反应方程式:
(3)上述反应过程中属于取代反应的是(填写代码) 。
(4)丙烯酰胺在一定条件下能发生水解反应,试写出其在NaOH溶液中水解的化学方程式:
一、单项选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.A 2.C 3.B 4.D 5.C 6.D 7.C 8.B
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.AC 10.BD 11.B 12.AB 13.D 14.B
三、非选择题(共7小题,72分)
15.⑴ CaCO3+2H+=Ca2++H2O+CO2↑ 除去碳酸钙等不溶性杂质
⑵ 检验HCO3―离子 另取一份滤液,加入NaOH溶液,观察有无沉淀产生
⑶ 同时将滤液和饱和氯水滴在有色布条上,比较有色布条褪色的快慢
(每空2分,共10分)
16.⑴NaOH溶液和稀硫酸 ⑵在隔绝空气的条件下,蒸发浓缩、冷却结晶 将滤渣F在空气中灼烧 ⑶由滤液A制得氯化铝溶液不合理,所得氯化铝溶液中含有大量NaCl杂质 向滤液A中通入足量的CO2生成Al(OH)3沉淀,过滤,向Al(OH)3沉淀中加入盐酸至沉淀溶解
(每空2分,共10分)
17.⑴CuSO4 ⑵烧杯中有硫酸,黑色固体不溶于硫酸 ⑶①CuS+8HNO3=CuSO4+8NO2↑+4H2O ②所得溶液为蓝色,加BaCl2溶液后有白色沉淀生成 ③将黑色固体在空气中灼烧,比较反应前后固体的质量
(每空2分,共10分)
18.⑴保护臭氧层
⑵①2KHCO3/江苏省如皋市2009届高三第一次统一考试化%20%20学%20试%20卷.files/image027.jpg) K2CO3+CO2↑+H2O
K2CO3+CO2↑+H2O
②CO2(g)+3H2(g) /江苏省如皋市2009届高三第一次统一考试化%20%20学%20试%20卷.files/image029.jpg) CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol
⑶Ba(OH)2(或NaOH溶液和BaCl2溶液) 实验时的温度、压强,沉淀的质量
(每空2分,共10分)
19.⑴Na+[/江苏省如皋市2009届高三第一次统一考试化%20%20学%20试%20卷.files/image031.jpg) ]2-Na+ ⑵白色物质迅速变为灰绿色,最终变为红褐色
]2-Na+ ⑵白色物质迅速变为灰绿色,最终变为红褐色
⑶3Fe+4H2O/江苏省如皋市2009届高三第一次统一考试化%20%20学%20试%20卷.files/image032.gif) Fe3O4+4H2↑ 在铝热剂上加少量KClO3,插上镁条并将其点燃 ⑷2Al+2OH-+2H2O=2AlO2-+3H2↑
Fe3O4+4H2↑ 在铝热剂上加少量KClO3,插上镁条并将其点燃 ⑷2Al+2OH-+2H2O=2AlO2-+3H2↑
(每空2分,共10分)
20.⑴CH3CHBrCH3 ⑵②④⑤⑦
⑶/江苏省如皋市2009届高三第一次统一考试化%20%20学%20试%20卷.files/image034.gif) +
+/江苏省如皋市2009届高三第一次统一考试化%20%20学%20试%20卷.files/image036.gif) +2H2O
+2H2O
⑷/江苏省如皋市2009届高三第一次统一考试化%20%20学%20试%20卷.files/image025.gif) +2NaOH
+2NaOH/江苏省如皋市2009届高三第一次统一考试化%20%20学%20试%20卷.files/image038.gif) +H2O+NaBr
+H2O+NaBr
⑸HOCH2CH2CH2CHO CH3CH(OH)CH2CHO CH3CH2CH(OH)CHO
(CH3)
(第⑸小题4分,其余每空2分,共12分)
21.⑴参加反应的硝酸的物质的量为(13.5mol/L-1mol/L)×0.080 mol/L=1 mol
被还原的硝酸的物质的量即生成气体的物质的量:/江苏省如皋市2009届高三第一次统一考试化%20%20学%20试%20卷.files/image040.gif) =0.3 mol
=0.3 mol
则未被还原的硝酸的物质的量为1mol-0.3mol=0.7 mol
即生成物AgNO3、Cu(NO3)2中含NO3-0.7 mol
设合金中银的质量为x,则:/江苏省如皋市2009届高三第一次统一考试化%20%20学%20试%20卷.files/image042.gif) ×1+
×1+/江苏省如皋市2009届高三第一次统一考试化%20%20学%20试%20卷.files/image044.gif) ×2=0.7 mol
×2=0.7 mol
解得:x=/江苏省如皋市2009届高三第一次统一考试化%20%20学%20试%20卷.files/image046.gif) =0.36(36%)
=0.36(36%)
(4分)
⑵若生成的0.3 mol气体全部是NO2,则应转移电子0.3 mol
若生成的0.3 mol气体全部是NO,则应转移电子0.9 mol
而合金溶于硝酸时转移电子数为:/江苏省如皋市2009届高三第一次统一考试化%20%20学%20试%20卷.files/image048.gif) ×1+
×1+/江苏省如皋市2009届高三第一次统一考试化%20%20学%20试%20卷.files/image050.gif) ×2=0.7 mol
×2=0.7 mol
所以生成的气体中既有NO2,又有NO
根据3n(NO)+n(NO2)=0.7 mol n(NO)+n(NO2)=0.3 mol
算出n(NO)=0.2 mol,n(NO2)=0.1 mol
即V(NO)=
(6分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com