
题目列表(包括答案和解析)
铁的氧化物有多种用途。请解答下面有关问题:
(1)赤铁矿的主要成分是Fe2O3,是工业炼铁的主要原料之一。写出由Fe2O3制得单质铁的化学方程式____________。某赤铁矿除了含Fe2O3之外,还含有少量的SiO2和Al2O3。将试样溶于NaOH溶液,充分反应后过滤,即可得到较纯净的Fe2O3。该过程中发生反应的离子方程式是____________。
(2)Fe2O3可以与铝粉组成铝热剂用于焊接钢轨或定向爆破。某同学猜测,该反应所得熔融物中含有Fe2O3。他设计如下实验来验证自己的猜想:取少量试样,加入足量稀盐酸,然后滴加KSCN溶液,若出现红色,证明含有Fe2O3。否则,不含有Fe2O3。你认为该方案合理吗?
为什么?
(4分)铁的氧化物有多种用途。请解答下面有关问题:
(1)赤铁矿的主要成分是Fe2O3,是工业炼铁的主要原料之一。写出由Fe2O3制得单质铁的化学方程式 。某赤铁矿除了含Fe2O3之处,还含有少量的SiO2和Al2O3。将试样溶于NaOH溶液,充分反应过滤,即可得到较纯净的Fe2O3。发生反应的离子方程式是 。
(2)Fe2O3可以与铝粉组成铝热剂用于焊接钢轨或定向爆破。某同学猜测,该反应所得熔融物中含有Fe2O3。他设计如下实验来验证自己的猜想:取少量试样,加入足量 稀盐酸,然后滴加KSCN溶液,若出现血红色,证明含有Fe2O3。否则,不含有Fe2O3。
你认为该方案合理吗?为什么? 。
(3)合成氨工业中所用的α―Fe催化剂的主要成分是FeO、Fe2O3。已知当催化剂中Fe2+和Fe3+的物质的量之比为1:2时,其催化活性最高。某化学小组试图以Fe2O3为原料制备该催化剂,方法之一是向其中加入炭粉高温反应:
![]()
实验教师提供了12g炭粉。请你计算,若要制取这种活性最高的催化剂,加入的Fe2O3的质量为 g。 该小组设计了多个实验方案来测定所得产品是否符合要求。其中一个实验方案是用氢气还原加热的混合物,测定铁的质量分数。在用锌跟稀硫酸反应制取氢气时,该小组的同学向稀硫酸中加入少量硫酸铜溶液,目的是 。当混合物中铁的质量分数为 (用化简的分数表示)时,该产品合格。
(1)乳酸可发生下列变化:
![]()
![]()
各步反应所用的试剂:①____________,②____________。
(2)乳酸可以与精制铁粉制备一种药物,反应化学方程式是:________________________。该反应中氧化剂是____________,还原产物是____________。
(3)若碳原子以单键与4个不同的原子或原子团相结合,则该碳原子被称为“手性碳原子”,含手性碳原子的分子称为“手性分子”,手性分子往往具有一定的生物活性。
乳酸分子是手性分子( ),其中的手性碳原子是_________号碳原子。
),其中的手性碳原子是_________号碳原子。
(4)乳酸的某种同分异构体,具有下列性质:①能发生银镜反应 ②能与金属钠反应,1 mol该物质与足量的钠反应可生成
近年来,乳酸CH3CH(OH)COOH成为人们的研究热点之一。乳酸可以用化学方法合成,也可以由淀粉通过生物发酵法制备。乳酸有许多用途,其中利用乳酸的聚合而合成的高分子材料,具有很好的生物兼容性,它无论在哺乳动物体内或自然环境中,最终都能够降解成为二氧化碳和水。请回答下列有关问题:
(1)乳酸在发生下列变化时所用的试剂是① ②

(2)乳酸可以跟精制的铁粉反应制备一种补铁的药物,反应的化学方程式为:
2CH3CH (OH) COOH+Fe→[CH3CH(OH)COO]2Fe+H2↑
该反应中氧化剂是 ,还原产物是
(3)由乳酸可以制取  ,请写出设计合成实验时所涉及的有机反应类型 。
,请写出设计合成实验时所涉及的有机反应类型 。
(4)聚乙烯、聚苯乙烯材料因难分解而给人类生存环境带来严重的“白色污染”,德国Danone公司开发了聚乳酸材料  ,它是由乳酸通过 反应制取的。聚乳酸包装材料能够在60天自行降解,降解过程分为两个阶段,首先在乳酸菌的作用下水解生成单体,然后乳酸单体在细菌的作用下与氧气反应转化为二氧化碳和水,请写出上述两个反应的化学方程式 ,
,它是由乳酸通过 反应制取的。聚乳酸包装材料能够在60天自行降解,降解过程分为两个阶段,首先在乳酸菌的作用下水解生成单体,然后乳酸单体在细菌的作用下与氧气反应转化为二氧化碳和水,请写出上述两个反应的化学方程式 ,
(5)若碳原子以单键与四个不同的原子或原子团相结合,则称该碳原子为“手性碳原子”,含有手性碳原子的分子称为“手性分子”,手性分子往往具有一定生物活性。乳酸分子是手性分子,乳酸[③CH3②CH(OH)①COOH]的手性碳原子是 号碳原子。
(6)乳酸的某种同分异构体具有下列性质:能发生银镜反应;1 mol该物质跟足量金属钠发生缓慢反应,生成2g氢气;该分子为手性分子。写出该物质的结构简式

 ,请写出设计合成实验时所涉及的有机反应类型 。
,请写出设计合成实验时所涉及的有机反应类型 。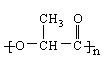 ,它是由乳酸通过 反应制取的。聚乳酸包装材料能够在60天自行降解,降解过程分为两个阶段,首先在乳酸菌的作用下水解生成单体,然后乳酸单体在细菌的作用下与氧气反应转化为二氧化碳和水,请写出上述两个反应的化学方程式 ,
,它是由乳酸通过 反应制取的。聚乳酸包装材料能够在60天自行降解,降解过程分为两个阶段,首先在乳酸菌的作用下水解生成单体,然后乳酸单体在细菌的作用下与氧气反应转化为二氧化碳和水,请写出上述两个反应的化学方程式 ,
说明:
1.本答案供阅卷评分使用,考生若写出其它正确答案,可参照评分标准给分。
2.化学专用名词中出现错别字、元素符号有错误,书写不规范,都不得分。
3.化学方程式、离子方程式不按要求书写、未配平都不得分。漏掉或写错反应条件扣1分。漏掉↑↓不扣分。
第Ⅰ卷(选择题,共40分)
选择题(本题包括16小题,每题只有一个选项符合题意,1至8题,每题2分;9至16题,每题3分,共40分)
|