
题目列表(包括答案和解析)
已知氧化性Fe3+>Cu2+>Fe2+。现有一包铁粉和铜粉混合粉末,某研究小组同学为了确定其组成,利用1.2mol/L的FeCl3溶液(其他用品略),与混合粉末反应,实验结果如下(假定反应前后溶液体积不变):
|
组别 |
① |
② |
③ |
④ |
|
V[FeCl3(aq)]/mL |
50 |
50 |
50 |
50 |
|
混合粉末质量/g |
1.2 |
2.4 |
3.6. |
4.8 |
|
反应后剩余固体质量/g |
0 |
0.64 |
1.92 |
3.12 |
分析表中数据,下列结论正确的是
A.第①组反应后溶液中剩余c(Fe3+)=0.4mol/L B.第②、③组剩余固体全是铜
C.第④组的滤液中c(Fe2+)=2.0mol/L D.原混合粉末中n(Fe)∶n(Cu)=1∶2
已知氧化性Fe3+>Cu2+>Fe2+。现有一包铁粉和铜粉混合粉末,某研究小组同学为了确定其组成,利用1.2mol/L的FeCl3溶液(其他用品略),与混合粉末反应,实验结果如下(假定反应前后溶液体积不变):
| 组别 | ① | ② | ③ | ④ |
| V[FeCl3(aq)]/mL | 50 | 50 | 50 | 50 |
| 混合粉末质量/g | 1.2 | 2.4 | 3.6. | 4.8 |
| 反应后剩余固体质量/g | 0 | 0.64 | 1.92 | 3.12 |
分析表中数据,下列结论正确的是
A.第①组反应后溶液中剩余c(Fe3+)=0.4mol/L B.第②、③组剩余固体全是铜
C.第④组的滤液中c(Fe2+)=2.0mol/L D.原混合粉末中n(Fe)∶n(Cu)=1∶2
已知氧化性Fe3+>Cu2+>Fe2+。现有一包铁粉和铜粉混合粉末,某研究小组同学为了确定其组成,利用1.2mol/L的FeCl3溶液(其他用品略),与混合粉末反应,实验结果如下(假定反应前后溶液体积不变):
| 组别 | ① | ② | ③ | ④ |
| V[FeCl3(aq)]/mL | 50 | 50 | 50 | 50 |
| 混合粉末质量/g | 1.2 | 2.4 | 3.6. | 4.8 |
| 反应后剩余固体质量/g | 0 | 0.64 | 1.92 | 3.12 |
分析表中数据,下列结论正确的是
A.第①组反应后溶液中剩余c(Fe3+)=0.4mol/L B.第②、③组剩余固体全是铜
C.第④组的滤液中c(Fe2+)=2.0mol/L D.原混合粉末中n(Fe)∶n(Cu)=1∶2
废旧物的回收利用既有利于节约资源,又有利于保护环境。某研究小组同学以废旧锌锰干电池为原料,将废旧电池含锌部分转化成ZnSO4·7H2O,含锰部分转化成纯度较高的MnO2,将NH4Cl溶液应用于化肥生产中,实验流程如下:

(1)操作②中所用的加热仪器应选 (选填“蒸发皿”或“坩埚”)。
(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+沉淀,请写出氨水和Fe3+反应的离子方程式 。
(3)操作⑤是为了除去溶液中的Zn2+。已知25℃时,
|
NH3·H2O的Kb |
Zn2+完全沉淀的pH |
Zn(OH)2溶于碱的pH |
|
1.8×10-5 |
8.9 |
>11 |
由上表数据分析应调节溶液pH最好为 (填序号)。
a.9 b.10 c.11
(4) MnO2精处理的主要步骤:
步骤1:用3%H2O2和6.0mol/L的H2SO4的混和液将粗MnO2溶解,加热除去过量H2O2,得MnSO4溶液(含少量Fe3+)。反应生成MnSO4的离子方程式为 ;
步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe3+沉淀完全,再加活性炭搅拌,抽滤。加活性炭的作用是 ;
步骤3:向滤液中滴加0.5mol/L的Na2CO3溶液,调节pH至7,滤出沉淀、洗涤、干燥,灼烧至黑褐色,生成MnO2。灼烧过程中反应的化学方程式为 。
(5) 查文献可知,粗MnO2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO3固体。
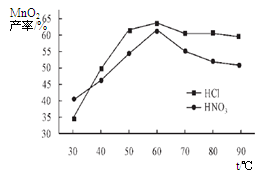
①在盐酸和硝酸溶液的浓度均为5mol/L、体积相等和最佳浸泡时间下,浸泡温度对MnCO3产率的影响如图4,由图看出两种酸的最佳浸泡温度都在 ℃左右;
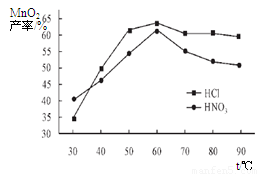
②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO3产率的影响如图5,由图看出硝酸的最佳浓度应选择 mol/L左右。
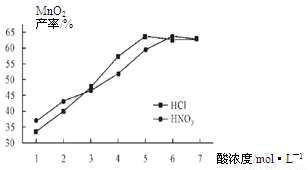
废旧物的回收利用既有利于节约资源,又有利于保护环境。某研究小组同学以废旧锌锰干电池为原料,将废旧电池含锌部分转化成ZnSO4·7H2O,含锰部分转化成纯度较高的MnO2,将NH4Cl溶液应用于化肥生产中,实验流程如下: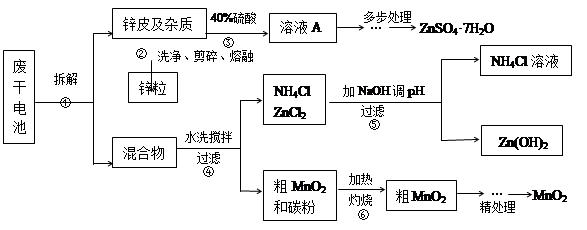
(1)操作②中所用的加热仪器应选 (选填“蒸发皿”或“坩埚”)。
(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+沉淀,请写出氨水和Fe3+反应的离子方程式 。
(3)操作⑤是为了除去溶液中的Zn2+。已知25℃时,
| NH3·H2O的Kb | Zn2+完全沉淀的pH | Zn(OH)2溶于碱的pH |
| 1.8×10-5 | 8.9 | >11 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com