
题目列表(包括答案和解析)
与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示,K只与温度有关)。下表是几种常见弱酸的电离平衡常数(25℃)。
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH | 1.76×10-5 |
| H2CO3 | H2CO3 HCO3― | K1==4.31×10-7 K2==5.61×10-11 |
| H3PO4 | H3PO4 H2PO4 HPO42 | K1==7.1×10-3 K2==6.3×10-8 K3==4.2×10-13 |
回答下列各题:
(1)温度升高时, (填“促进”或“抑制”)弱酸的电离,K值 (填“增大”、“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱关系是
。
(3)若把CH3COOH、H2CO3、HCO3-、H3PO4、H2PO4、HPO42-都看作是酸,则它们酸性强弱顺序是_________________________________________。
(4)若醋酸的起始浓度为0.010mol/L,则平衡时溶液的pH是多少?(写出计算过程,结果以对数形式表示)
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25℃时有HA![]() H++A―,则K==
H++A―,则K==![]() 式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH | 1.76×10―5 |
| H2CO3 | H2CO3 HCO3― | K1==4.31×10―7 K2==5.61×10―11 |
| H2S | H2S HS― | K1==9.1×10―8
K2==1.1×10―12 |
| H3PO4 | H3PO4 H2PO4― HPO42― |
K1==7.52×10―3 K2==6.23×10―8 K3==2.20×10―13 |
回答下列各题:
(1)K只与温度有关,当温度升高时,K值__________(填“增大”、“减小”、“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?___
__________________________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是__________,最弱的是_____________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是________________,产生此规律的原因是_______
____________________________。
(一)(1)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染。
已知: CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol
2CO (g) + O2(g) = 2CO2(g) ΔH2=―566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的________倍(计算结果保留1位小数)。
(2)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图: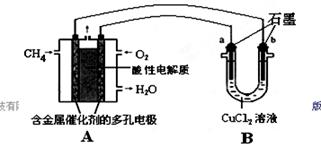
请回答:
①甲烷燃料电池的负极反应式是________。
②当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
(二)下表是几种弱电解质的电离平衡常数、难溶电解质的
溶度积Ksp (25℃)。
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH CH3COO-+H+ CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH  C6H5O-+H+ C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4 H++H2PO4- H++H2PO4-H2PO4-  H++HPO32- H++HPO32-HPO42-  H++PO43- H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| NH3·H2O | NH3·H2O NH4++OH- NH4++OH- | 1.76×10-5 | |
| BaSO4 | BaSO4 Ba2++SO42- Ba2++SO42- | | 1.07×10-10 |
| BaCO3 | BaCO3 Ba2++CO32- Ba2++CO32- | | 2.58×10-9 |
(一) (1)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染。
已知: CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol
2CO (g) + O2(g) = 2CO2(g) ΔH2=―566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的________倍(计算结果保留1位小数)。
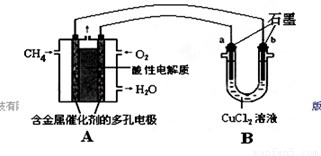
(2)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图:
请回答:
①甲烷燃料电池的负极反应式是________。
②当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
(二)下表是几种弱电解质的电离平衡常数、难溶电解质的
溶度积Ksp (25℃)。
|
电解质 |
平衡方程式 |
平衡常数K |
Ksp |
|
CH3COOH |
CH3COOH |
1.76×10-5 |
|
|
H2CO3 |
H2CO3 HCO3- |
K1=4.31×10-7 K2=5.61×10-11 |
|
|
C6H5OH |
C6H5OH |
1.1×10-10 |
|
|
H3PO4 |
H3PO4 H2PO4- HPO42- |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
|
|
NH3·H2O |
NH3·H2O |
1.76×10-5 |
|
|
BaSO4 |
BaSO4 |
|
1.07×10-10 |
|
BaCO3 |
BaCO3 |
|
2.58×10-9 |
回答下列问题:
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4- 均可看作酸,则它们酸性由强到弱的顺序为__________________________(填编号);
(2)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)______c(NH4+);(填“>”、“=”或“<”)
(3)25℃时,向10ml 0.01mol/L苯酚溶液中滴加Vml 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是( );
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c((NH4+) >c (C6H5O-) >c (H+)>c (OH-)
C.V=10时,混合液中水的电离程度小于10ml 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c (NH4+)= c (C6H5O-)+ c (C6H5OH)
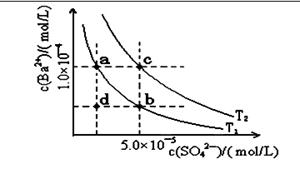
(4)如下图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是( )
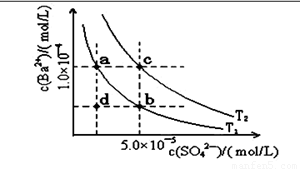
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时, 均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、 b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
一、选择题(每小题4分,共32分)
题号
1
2
3
4
5
6
7
8
答案
A
B
C
D
D
B
C
C
二、选择题(每小题4分,共32分)
题号
9
10
11
12
13
14
15
16
答案
B
BD
AD
B
BD
C
AD
AD
三、(本题包括2小题,共22分)
17.(每小条2分)(1)150mL,气体体积为110mL,量筒的量程越小,产生的误差越小;
(2)酸式滴定管,酸性KMnO4具有强氧化性,能腐蚀碱式滴定管的乳胶管;
(3)B,防止气体冷却时发生倒吸现象;此时读数由于量筒中气体压强小于外界大气压,使读的气体体积偏大,Na2O2纯度偏高;应慢慢把量筒往下移,使量筒中液面恰好与水槽中液面相平;
(4)溶液刚好出现浅紫红色,并在半分钟内不褪色;
(5)62.4%
 18.
18.
四、(本题包括2小题,共18分)
19.(1)S1>S3>S2>S4(2分)(2)①b ②c (各1分,共2分)
(3)①HClO4(1分)②离子键、(极性)共价键(1分) NaClO(1分)
③SiO2+2C Si+2CO↑(1分)
Si+2CO↑(1分)
20.(1)D为FeSO4(2分),E为H2S (2分)
(2)离子方程式2Fe3++SO2+2H2O=2Fe2++4H++SO42-(2分)
(3)离子方程式2Cu2++2H2O 2Cu+4H++O2↑(2分)
2Cu+4H++O2↑(2分)
(4)称一定量的Cu2S和CuS充分燃烧,再称燃烧后的产物,若燃烧后的质量和反应物的质量相等,则被燃烧的物质是Cu2S,若燃烧后的质量比原来的反应物质量少,则被燃烧的物质是CuS。(2分)
五、(本题包括1小题,共10分)
21.(1)温度升高,促进电离,所以K值增大(2分)
(2)K值越大,电离出的氢离子浓度越大,所以酸性越强(2分)
(3)H3PO4 HPO42―(2分)
(4)K1:K2:K3≈1:10―5:10―10 (2分) 上一级电离产生的H+对下一级电离有抑制作用 (2分)
六、(本题包括2小题,共18分)

 22.(8分)(I)C2nH3nPn
。
22.(8分)(I)C2nH3nPn
。
(II)C20H30O2,
23.(10分)
(1) (3分) (2)略(3分) (3)4(2分)
(4)7(2分)
(3分) (2)略(3分) (3)4(2分)
(4)7(2分)
七、(本题包括2小题,共18分)
24.(6分)(1)44 (2分) (2)A分子中含一个羟基和一个羧基,1molA消耗2molNaOH n(HCl)= 0.02 L×0.100mol/L= 0.002mol (1分) 。苯酚与A的混合物消耗的NaOH物质的量为:0.05L×1.000mol/L―0.002mol× =0.03mol (1分) 依题意可得:
=0.03mol (1分) 依题意可得:
 n(C6H5OH)+2×n(A)=0.03mol
n(C6H5OH)+2×n(A)=0.03mol
94 g/mol×n(C6H5OH)+138g/mol×n(A)=2.32 g
n(C6H5OH)=0.01mol m(C6H5OH)=0.94g
w (C6H5OH)= ×100%=40.5%(或0.405) (2分)
×100%=40.5%(或0.405) (2分)
25.⑴(共4分)NaOH+HCl=NaCl+H2O NH3+HCl=NH4Cl
20.00mLB溶液消耗0.1000mol?L-1NaOH 30.00mL。
20.00mLB溶液中过量的HCl:n(HCl)=0.003000mol ,
100mLB溶液中过量的HCl:n(HCl)=0.01500mol那么与NH3反应的n(HCl)=0.01000mol
故0.5010g样品中 n(NH3)=0.01000mol n(N)=0.01000mol(2分)
[Co(NH3)xCly]Clz中氮元素的质量分数
 (2分)
(2分)
⑵(共6分)I2+2Na2S2O3==2NaI+Na2S4O6
因反应用去0.1000mol?L-1Na2S2O3溶液20.00mL,推算出:n(I2)=0.001000mol(1分)
Co与Fe同一族,Com+具有强氧化性,故设m=3
则有:2Co3++2I-==2Co2++I2 n(Co3+)=0.002000mol (1分)
0.5010g样品中Cl的总质量为:
m(Cl)=0.5010g-0.002000molx59g?mol -1-0.01000molx17g ?mol -1=0.2130g
n(Cl)=0.006000mol(1分)
又有:[Co(NH3)xCly]Clz+zAgNO3==[Co(NH3)xCly](NO3)z+zAgCl↓
0.2505g样品扩大一倍来算(即用0.5010g)推算出:
反应消耗AgNO3:n(AgNO3)=0.1000mol?L-1x40.00mL=0.004000mol
即发生上述反应的Cl-为:n(Cl-) =0.004000mol(1分)
则有 y:z=(0.006000mol-0.004000 mol): 0.004000mol=1:2
同时还有:1:x:(y+z)= 0.002000: 0.01000: 0.006000=1:5:3
解得:x=5 y=1 z=2
带入[Co(NH3)xCly]Clz中,求得Co化合价为:+3 假设成立
该钴化合物的化学式为:[Co(NH3)5Cl]Cl2(3分)
答:⑴[Co(NH3)xCly]Clz中氮元素的质量分数为27.94%
⑵该钴化合物的化学式为:[Co(NH3)5Cl]Cl2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com