
题目列表(包括答案和解析)
| |||||||||||||||||||
pH<7的x溶液中含有三种常见金属阳离子,用x溶液进行如下实验:
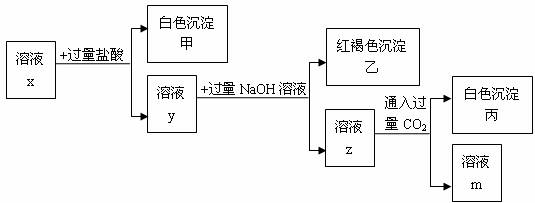
(1)根据有白色沉淀甲生成,判断x溶液中有 阳离子;根据有白色沉淀丙生成,判断x溶液中有 阳离子。
(2)写出由溶液y生成红褐色沉淀乙的离子方程式 。
(3)x溶液中一定含有的阴离子是 。
(4)根据上述实验 (填“能”或“不能”)确定x溶液中的第3种金属阳离子,理由是 。


A.取适量试液,加入过量盐酸,有气体生成,并得到溶液;?
B.在A所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;?
C.在B所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉沉乙析出。?
根据上述实验回答下列问题:?
(1)溶液中一定不存在的离子是_______________。?
(2)一定存在的离子是________________。?
(3)判断沉淀乙成分的方法是_______________。??
A.取适量试液,加入过量盐酸,有气体生成,并得到溶液;?
B.在A所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;?
C.在B所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉沉乙析出。?
根据上述实验回答下列问题:?
(1)溶液中一定不存在的离子是_______________。?
(2)一定存在的离子是________________。?
(3)判断沉淀乙成分的方法是_______________。??
1
2
3
4
5
6
7
8
9
10
B
D
D
C
A
C
A
A
B
C
11
12
13
14
15
16
17
18
19
20
A
B
AD
B
B
CD
D
C
D
B
21.(4分)BCD
22.(5分)④⑥①③
23、(10分)(1)右(2分),左手拿药匙,右手轻拍左手的手腕,让药匙中的药品轻轻洒落,直到加足药品(3分)。
(2)砝码放在左边,烧杯放在右边(2分),
24.(9分)⑴abcd (3分) (2) ①(3分)2P(s)+3Cl2(g)=2PCl3(g) △H=-612kJ/mol
②(3分)PCl5(g)=PCl3(g)+Cl2(g) △H=+93kJ/mol
25.(12分)⑴Ag+ (2分)
⑵Al3+ (2分) AIO2― + 2H2O + CO2 = Al(OH)3↓+ HCO3- (2分)
⑶NO3- (2分)
⑷不能 (2分) H+和NO3-能把 Fe2+ 氧化为Fe3+ (2分)
26.(14分)(1)C F G (2分)
(2)6Fe2+ + ClO3― + 6 H+ = 6Fe3+ + Cl― + 3H2O (4分),
不影响(2分)
(3)坩埚(2分)
 (4)
(4)
 ×2×
×2× g×100% (4分)
g×100% (4分)
27.(14分)
(1)使Ca2+、Al3+、Fe3+浸出(或使Ca2+、Al3+、Fe3+溶解)(3分)
(2)Ca2++(NH4)
(3)Fe(OH)3、Al(OH)3(各1分,共2分)
(4)Fe3++3SCN― Fe(SCN)3(写成其它正确的络合离子形式给分,2分)
Fe(SCN)3(写成其它正确的络合离子形式给分,2分)
(5)使Fe3+转化为Fe(OH)3沉淀(2分);
⑹检验Al3+(或铝元素)存在 (2分)。
28.(12分) ⑴将含氰化合物全部转化为CN -(2分)
⑵完全吸收HCN,防止气体放空(2分)
⑶防止倒吸(2分)
⑷偏高 (2分)
⑸109.2(4分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com