
题目列表(包括答案和解析)
下列实验操作或对实验事实的叙述中存在错误的是________(填序号)
A、用50mL酸式滴定管准确量取25.00mL酸性KMnO4溶液,放入锥形瓶中待用
B、在测定硫酸铜晶体的结晶水时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量
C、中和热的测定所需的玻璃仪器有烧杯、温度计、量筒
D、实验室中进行的下列实验需水浴加热:①乙酸乙酯的制备②葡萄糖的银镜反应
E、配制1mol?L-1的NaOH溶液时,下列操作会造成所配浓度偏低:①溶解后烧杯未多次洗涤②定容时仰视刻度线③容量瓶中原有少许蒸馏水
F、实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
G、容量瓶检漏:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置数次,观察是否漏水
H、不用其他试剂无法鉴别下列四种溶液:Na2CO3、Al2(SO4)3、NaCl、NaHSO4
I、可以用分液漏斗分离下列三组液态混合物:硝基苯和水、油酸和水、乙酸乙酯和乙醇
J、实验室保存少量液溴和白磷常用水封
(2)某研究性学习小组拟用明矾制取Al2(SO4)3晶体和K2SO4晶体.
①实验室除明矾外,已备好的用品有蒸馏水、氨水、pH试纸,还缺少的试剂有________.
②制得Al2(SO4)3与K2SO4物质的量之比小于________.
(3)“磨砂”是增加玻璃仪器密封性的一种处理工艺,可使仪器不漏液或不漏气.在下列仪器中:①试管;②分液漏斗;③细口试剂瓶;④广口试剂瓶;⑤集气瓶;⑥滴瓶;⑦酸式滴定管;⑧碱式滴定管,肯定用不到“磨砂”处理的有(填序号).
(4)碱式氯化铜(不溶于水的绿色结晶)是一种农药,化学式为:CuCl2·3Cu(OH)2·xH2O.为验证其组成并确定X值,某学生设计了以下几步实验
①取ag碱式氯化铜的晶体制成粉末.
②将晶体加热至确认质量不再变化为止(铜仍为二价),冷却后称其质量为bg.
③另取ag碱式氯化铜的晶体,溶于足量硝酸中,得到溶液.
④向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体,称量为cg.
若以上操作均正确,试回答下列问题:
A、将晶体制成粉末,所用的主要化学仪器是________(填仪器名称).以上四步中,用到玻璃棒的步骤有________(填序号)
B、步骤②灼烧后得到的固体应为:________.
C、步骤④主要包括:加入足量硝酸银溶液→________→________→晾干→称量
(15分)为测定某![]() 样品(含少量
样品(含少量![]() 杂质)的纯度,实验室按以下步骤进行:①称取
杂质)的纯度,实验室按以下步骤进行:①称取![]()
 样品,置于烧杯中;
样品,置于烧杯中;
②加入适量蒸馏水,使样品溶解,然后配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液;
然后,可采用下列两种方法进行测定:
| 方法一 | 方法二 |
| ④将25.00mL溶液置于烧杯中,加入过量的稀盐酸充分搅拌; ⑤加入过量 ⑥过滤、洗涤、干燥沉淀、称量得到bg固体。 | ④将25.00mL溶液置于锥形瓶中; ⑤用0.1 mol |
请根据上述实验,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用的的仪器是E和_______(填字母);
(2)在方法一④中加入过量稀盐酸的目的是____________________________________;
(3)在方法一测定得到![]() 样品的纯度是______________(列出算式,可不化简);
样品的纯度是______________(列出算式,可不化简);
(4)在方法二中,是否需要加入指示剂________(填“是”或“否”),请简述理由___
__________________________________________________________________;
(5)在方法二中达到滴定终点读取数据时,俯视液面,则测定结果___________________(填“偏高”、“偏低”、“无影响”)。
(15分)为测定某 样品(含少量
样品(含少量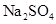 杂质)的纯度,实验室按以下步骤进行:①
称取
杂质)的纯度,实验室按以下步骤进行:①
称取
 样品,置于烧杯中;
样品,置于烧杯中;
②加入适量蒸馏水,使样品溶解,然后配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液;
然后,可采用下列两种方法进行测定:
|
方法一 |
方法二 |
|
④将25.00mL溶液置于烧杯中,加入过量的稀盐酸充分搅拌; ⑤加入过量 ⑥过滤、洗涤、干燥沉淀、称量得到bg固体。 |
④将25.00mL溶液置于锥形瓶中; ⑤用0.1 mol |

请根据上述实验,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用的的仪器是E和_______(填字母);
(2)在方法一④中加入过量稀盐酸的目的是____________________________________;
(3)在方法一测定得到 样品的纯度是______________(列出算式,可不化简);
样品的纯度是______________(列出算式,可不化简);
(4)在方法二中,是否需要加入指示剂________(填“是”或“否”),请简述理由___
__________________________________________________________________;
(5)在方法二中达到滴定终点读取数据时,俯视液面,则测定结果___________________(填“偏高”、“偏低”、“无影响”)。
为测定某![]() 样品(含少量
样品(含少量![]() 杂质)的纯度,实验室按以下步骤进行:① 称取
杂质)的纯度,实验室按以下步骤进行:① 称取![]()
![]() 样品,置于烧杯中;
样品,置于烧杯中;
②加入适量蒸馏水,使样品溶解,然后配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液;
然后,可采用下列两种方法进行测定:
| 方法一 | 方法二 |
| ④将25.00mL溶液置于烧杯中,加入过量的稀盐酸充分搅拌; ⑤加入过量 ⑥过滤、洗涤、干燥沉淀、称量得到bg固体。 | ④将25.00mL溶液置于锥形瓶中; ⑤用0.1 mol |
| 方法一 | 方法二 |
| ④将25.00mL溶液置于烧杯中,加入过量的稀盐酸充分搅拌; ⑤加入过量BaCl2溶液,充分搅拌,使沉淀完全; ⑥过滤、洗涤、干燥沉淀、称量得到bg固体. |
④将25.00mL溶液置于锥形瓶中; ⑤用0.1mol/L的酸性KMnO4溶液进行滴定,达到滴定终点时,消耗10.00mL溶液. |

| 1420b |
| 233a |
| 1420b |
| 233a |
1
2
3
4
5
6
7
8
9
10
B
D
D
C
A
C
A
A
B
C
11
12
13
14
15
16
17
18
19
20
A
B
AD
B
B
CD
D
C
D
B
21.(4分)BCD
22.(5分)④⑥①③
23、(10分)(1)右(2分),左手拿药匙,右手轻拍左手的手腕,让药匙中的药品轻轻洒落,直到加足药品(3分)。
(2)砝码放在左边,烧杯放在右边(2分),
24.(9分)⑴abcd (3分) (2) ①(3分)2P(s)+3Cl2(g)=2PCl3(g) △H=-612kJ/mol
②(3分)PCl5(g)=PCl3(g)+Cl2(g) △H=+93kJ/mol
25.(12分)⑴Ag+ (2分)
⑵Al3+ (2分) AIO2― + 2H2O + CO2 = Al(OH)3↓+ HCO3- (2分)
⑶NO3- (2分)
⑷不能 (2分) H+和NO3-能把 Fe2+ 氧化为Fe3+ (2分)
26.(14分)(1)C F G (2分)
(2)6Fe2+ + ClO3― + 6 H+ = 6Fe3+ + Cl― + 3H2O (4分),
不影响(2分)
(3)坩埚(2分)
 (4)
(4)
 ×2×
×2× g×100% (4分)
g×100% (4分)
27.(14分)
(1)使Ca2+、Al3+、Fe3+浸出(或使Ca2+、Al3+、Fe3+溶解)(3分)
(2)Ca2++(NH4)
(3)Fe(OH)3、Al(OH)3(各1分,共2分)
(4)Fe3++3SCN― Fe(SCN)3(写成其它正确的络合离子形式给分,2分)
Fe(SCN)3(写成其它正确的络合离子形式给分,2分)
(5)使Fe3+转化为Fe(OH)3沉淀(2分);
⑹检验Al3+(或铝元素)存在 (2分)。
28.(12分) ⑴将含氰化合物全部转化为CN -(2分)
⑵完全吸收HCN,防止气体放空(2分)
⑶防止倒吸(2分)
⑷偏高 (2分)
⑸109.2(4分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com