
题目列表(包括答案和解析)

| ||
| ||
- 2 |
- 4 |
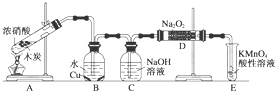
已知,室温下存在反应3HNO2===HNO3+2NO↑+H2O;在酸性溶液中,NO![]() 可将 MnO
可将 MnO![]() 还原为Mn2+且无气体生成。某化学兴趣小组设计了如下探究实验:
还原为Mn2+且无气体生成。某化学兴趣小组设计了如下探究实验:

请回答下列问题:
(1)装置A的试管中发生反应的化学方程式是 。
(2)B瓶中可以观察到的现象是 ,C瓶出来的气体是 。
(3)实验时观察到D 管内固体颜色逐渐变为白色。据此甲同学认为D管中生成物是NaNO3,而乙同学则认为D管中生成的是NaNO2,如何证明乙同学的观点正确?
| 实验方法 | 实验现象 | 反应的离子方程式 |
(4)E装置的作用是 。
(5)同学们经讨论认为上述装置仍有缺陷,为了避免D管中生成NaOH,你认为应该进行的改进是 。
已知,室温下存在反应3HNO2===HNO3+2NO↑+H2O;在酸性溶液中,NO![]() 可将 MnO
可将 MnO![]() 还原为Mn2+且无气体生成;酸性KMnO4溶液可吸收氮的氧化物。某化学兴趣小组设计了如下探究实验(实验前先排尽装置中的空气):
还原为Mn2+且无气体生成;酸性KMnO4溶液可吸收氮的氧化物。某化学兴趣小组设计了如下探究实验(实验前先排尽装置中的空气):

请回答下列问题:
(1)装置A的试管中发生反应的化学方程式是 。
(2)B瓶中可以观察到的现象是 ,C瓶出来的气体是 。
(3)实验时观察到D 管内固体颜色逐渐变为白色。据此甲同学认为D管中生成物是NaNO3,而乙同学则认为D管中生成的是NaNO2,如何证明乙同学的观点正确?
| 实验操作 | 实验现象 | 实验结论 |
| D管生成的是NaNO2 |
(4)E装置的作用是 。
(5)同学们经讨论认为上述装置仍有缺陷,为了避免D管中生成NaOH,你认为应该进行的改进是 。
| 装置编号 | 实验现象 | 反应的离子方程式 | SO2表现的化学性质 |
| 乙 | - | ||
| 丙 | 黄色溶液变为浅绿色 |
2- 3 |
2- 4 |
2- 3 |
2- 4 |
| 编号 | 实验操作 | 预期现象和结论 | ||
| 步骤① | 取少量待测液于试管A中,滴加2mol?L-1盐酸至溶液呈酸性,加入几滴 |
| ||
| 步骤② | ||||
| 步骤③ | 另取少量待测液于试管C中,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色 | 证明待测液中含有Br- |
1.D 2.C 3.D 4.C 5.A 6.D 7.C 8.D 9.C
10.D 11.D 12.D 13.C 14.B 15.A
16.(1)Fe2(SO4)3(1分)
(2)SnC12; SnC14(各1分)
得2×e -
 |
 |
||

 (3)Fe2(SO4)3+SnC12+2HC1==2FeSO4+SnC14+H2SO4(2分)
(3)Fe2(SO4)3+SnC12+2HC1==2FeSO4+SnC14+H2SO4(2分)
 |
失2e -
(4)1:2(2分)
17.(1)第三周期VIA族(1分)
(2)CO2属于分子晶体而SiO2属于原子晶体(2分)
(3)NH3+HNO3 NH4NO3(2分)
(4)H2S、SiH4、C2H2H4(写出3种即可)(3分)
△
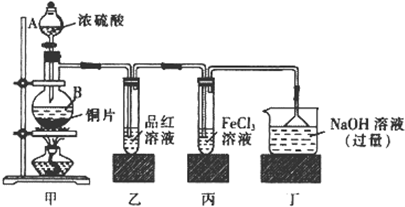
18.(1)MnO3+4H-+2C1- Mn2-+C12↑+2H2O(2分)
(2)III(1分)
(3)H+; HC1O; C12 (各1分)
(4)溶液由无色变成蓝色(1分)
(5)通过分液漏斗注入一定量的NaOH溶液,再摇动烧瓶使之充分反应(2分)
19.(1)NaHCO3; Na2CO3(各1分)
(2)C1O‑+CO2+H2O HCO3-+HC1O(2分)
(3)2(2分)
(4)C12+Na2CO3+H2O NaC1+NaHCO3+HC1O(2分)
20.(1)不能确定:Ba2+、Mg2_
(2)
阴离子符号
物质的量浓度(mol?L―1)
SO42-
0.1
CO32-
0.2
(3)存在:溶液中肯定存在离子是NH4+、CO32-和SO42-。经计算,NH4+的物质量为0.05mol,CO32-、SO42-的物质的量分别为0.02mol和0.01mol,根据电荷守恒,得K+一定存在(每空1分)
21.(1)小于(1分)
(2)
序号

反应①的
△H/(kJ?mol-1)
反应②的
△H/(kJ?mol-1)
总反应的
△H/(kJ?mol-1)
I
+216
+198
Ⅱ
0.5
+108
(各1分)
(3)1:15(2分)
22.(1)烧杯、胶头滴管(2分)
(2)3.95(2分)
(3)根据题意有:
Ba2+ ~ BaCrO4 ~  Cr2O72- ~
Cr2O72- ~  I2
~ 3S2O32-
I2
~ 3S2O32-
1 mol 3mol
c(Ba2+)×50.00mL×10-3L?mL-1 0.1mol?L-1×36.00mL×10-3L?mL-1
c(Ba2+)
=0.24mol?L-1(4分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com