
题目列表(包括答案和解析)
(1)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气, 已知
N2(g)+2O2(g)=2NO2(g) H1 =+ 67.7kJ/mol
N2H4(g)+O2(g)= N2(g)+2H2O(g) H2=- 534kJ/mol
试写出N2H4与 NO2反应的热化学方程式 ____________
(2)由氢气和氧气反应生成1mol水蒸气放热241.8KJ,写出该反应的热化学方程式_______________________ __________ 。
若1g水蒸气转化成液态水时放热2.444KJ,则反应H2(g) + 1/2O2(g) == H2O(l)的
△H=______________ kJ?![]() 。
。
(1)下列物质中,哪些形成分子内氢键,哪些形成分子间氢键?(填序号)

![]()

⑨HNO3 ⑩NH3
形成分子内氢键的有 ;形成分子间氢键有
(2)二聚甲酸解聚反应为:(HCOOH)2 → 2 HCOOH,该反应需吸收60KJ.mol-1的能量,此能量是断开___ _键所需的能量,所以此键的键能为___ _KJ.mol-1。
(3)氢键一般用X―H???Y表示。根据氢键形成的条件,可以推测还有____ 元素的原子可以代替氢原子而形成类似氢键的结构。
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ?mol-1)P―P:198 P―O:360 氧―氧键的键能:498。则反应
P4(白磷)+3O2→P4O6的反应热△H为( )

A.-1638kJ/mol B.+1638kJ/mol
C.-126kJ/mol D.+126kJ/mol
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能。
![]()
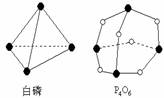
则反应P4(白磷)+3O2 === P4O6的反应热△H为( )
A.-1638 kJ?mol-1 B.+1638 kJ?mol-1
C.-126 kJ?mol-1 D.+126 kJ?mol-1
化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )
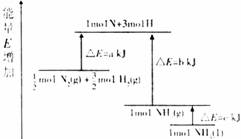
A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ?mol-1
B. N2(g)+3H2(g)=2NH3(g); △H=2(b-a)kJ?mol-1
C.![]() N2(g)+
N2(g)+![]() H2(g)=NH3(1); △H=(b+c-a)kJ?mol-1
H2(g)=NH3(1); △H=(b+c-a)kJ?mol-1
D.![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g); △H=(a+b)kJ?mol-1
H2(g)=NH3(g); △H=(a+b)kJ?mol-1
1.D 2.C 3.D 4.C 5.A 6.D 7.C 8.D 9.C
10.D 11.D 12.D 13.C 14.B 15.A
16.(1)Fe2(SO4)3(1分)
(2)SnC12; SnC14(各1分)
得2×e -
 |
 |
||

 (3)Fe2(SO4)3+SnC12+2HC1==2FeSO4+SnC14+H2SO4(2分)
(3)Fe2(SO4)3+SnC12+2HC1==2FeSO4+SnC14+H2SO4(2分)
 |
失2e -
(4)1:2(2分)
17.(1)第三周期VIA族(1分)
(2)CO2属于分子晶体而SiO2属于原子晶体(2分)
(3)NH3+HNO3 NH4NO3(2分)
(4)H2S、SiH4、C2H2H4(写出3种即可)(3分)
△
18.(1)MnO3+4H-+2C1- Mn2-+C12↑+2H2O(2分)
(2)III(1分)
(3)H+; HC1O; C12 (各1分)
(4)溶液由无色变成蓝色(1分)
(5)通过分液漏斗注入一定量的NaOH溶液,再摇动烧瓶使之充分反应(2分)
19.(1)NaHCO3; Na2CO3(各1分)
(2)C1O‑+CO2+H2O HCO3-+HC1O(2分)
(3)2(2分)
(4)C12+Na2CO3+H2O NaC1+NaHCO3+HC1O(2分)
20.(1)不能确定:Ba2+、Mg2_
(2)
阴离子符号
物质的量浓度(mol?L―1)
SO42-
0.1
CO32-
0.2
(3)存在:溶液中肯定存在离子是NH4+、CO32-和SO42-。经计算,NH4+的物质量为0.05mol,CO32-、SO42-的物质的量分别为0.02mol和0.01mol,根据电荷守恒,得K+一定存在(每空1分)
21.(1)小于(1分)
(2)
序号

反应①的
△H/(kJ?mol-1)
反应②的
△H/(kJ?mol-1)
总反应的
△H/(kJ?mol-1)
I
+216
+198
Ⅱ
0.5
+108
(各1分)
(3)1:15(2分)
22.(1)烧杯、胶头滴管(2分)
(2)3.95(2分)
(3)根据题意有:
Ba2+ ~ BaCrO4 ~  Cr2O72- ~
Cr2O72- ~  I2
~ 3S2O32-
I2
~ 3S2O32-
1 mol 3mol
c(Ba2+)×50.00mL×10-3L?mL-1 0.1mol?L-1×36.00mL×10-3L?mL-1
c(Ba2+)
=0.24mol?L-1(4分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com