
题目列表(包括答案和解析)
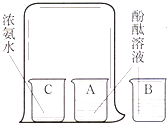 课上老师演示了如图所示的探究分子性质的实验.
课上老师演示了如图所示的探究分子性质的实验.| 实验步骤 | 实验现象 | 实验结论 |

| ||
| ||
| 编号 | 称量物 | 反应前 | 反映后 |
| 一 | 硬质玻璃管及所盛固体总质量 | 76.2g | 73.8g |
| 二 | C装置总质量 | 153.7g | 160.3g |
| ||
| 160 |
| 132 |
| X |
| 6.6g |
| 8g |
| 10g |
| ||
| 160 |
| 132 |
| X |
| 6.6g |
| 8g |
| 10g |
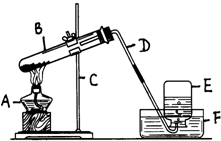 高锰酸钾制取并收集氧气的装置如下:a写出A.B.C.D.E.F仪器的名称
高锰酸钾制取并收集氧气的装置如下:a写出A.B.C.D.E.F仪器的名称湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com