
题目列表(包括答案和解析)
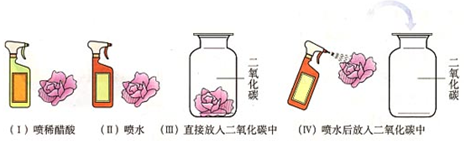
| 实验步骤 | 实验操作 | 实验现象 | 实验结论 | |
| 1 | 将紫色石蕊溶液浸泡过的干燥“小人”,两袖分别滴加稀醋酸 |  |
袖子变红 | 石蕊遇酸变红 |
| 2 | 裤子上滴蒸馏水 |  |
裤子不变色 | 石蕊遇水不变色 |
| 3 | 将“小纸人”放入盛有干燥的CO2集气瓶中 将“小纸人”放入盛有干燥的CO2集气瓶中 |
 |
上衣不变色,裤 子变红 |
和反应生成的碳酸使石蕊变红,化学方程式: CO2+H2O=H2CO3 CO2+H2O=H2CO3 |
| 4 | 将“小纸人”取出,用热宝加热 |  |
小纸人裤子变成紫色 小纸人裤子变成紫色 |
碳酸不稳定,易分解 |
| 品名 | 钙尔奇-D | 凯思立-D | 乐力钙 | 柠檬酸钙 |
| 主要含钙物质 | 碳酸钙 | 碳酸钙 | 氨基酸螯合钙 | 枸橼酸钙 |
| 该元素含量(mg/片) | 600 | 500 | 250 | 168 |
| 数量(片)/瓶(盒) | 30 | 20 | 30 | 30 |
| 价格(元)/瓶(盒) | 27.00 | 23.10 | 30.00 | 25.20 |
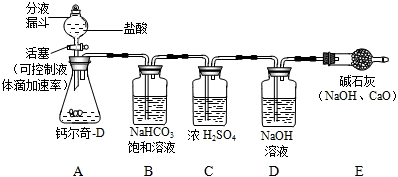
 20、某课外活动小组研究外界条件对水中氧气含量的影响.他们利用仪器测得以下数据.
20、某课外活动小组研究外界条件对水中氧气含量的影响.他们利用仪器测得以下数据.| 时 间 | 6:30 | 11:30 | 16:30 | 20:30 |
| 气温(℃) | 25 | 28 | 3l | 27 |
| 水中氧气的含量(mg/L) | 7.0 | 10.2 | 12.7 | 6.8 |
| 地 点 | 造纸厂的排污口 | 菜市场的下水道 | 家中自来水 | 生长着植物的人工湖 |
| 水中氧气的含量(mg/L) | 0.2 | 1.2 | 15.0 | 11.8 |
 2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:________
2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:________| 金属 | Ti | Mg | Ag |
| 反应现象 | 反应缓慢 | 反应强烈 | 无明显现象 |
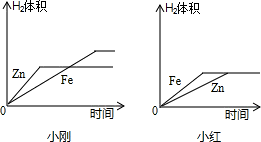
| 次数 | 1 | 2 | 3 | 4 |
| 加入酸质量/g | 5.0 | 5.0 | 5.0 | 5.0 |
| 剩余固态质量/g | 4.5 | 4 | 3.5 | 3.2 |
 2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:_________
2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:_________


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com