
题目列表(包括答案和解析)
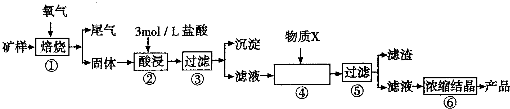
某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O晶体。

已知:常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
|
金属离子 |
氢氧化物开始沉淀的pH |
氢氧化物沉淀完全的pH |
|
Fe2+ |
7.0 |
9.0 |
|
Fe3+ |
1.9 |
3.2 |
|
Cu2+ |
4.7 |
6.7 |
回答下列问题:
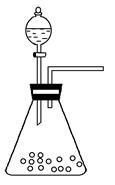
(1)步骤①的焙烧过程中需要通入氧气。在实验室中,可使用常见化学物质利用右图所示装置制取氧气,试写出熟悉的符合上述条件的两个化学方程式:______、______

(2)培烧产生的尾气中含有的一种气体是形成酸雨的污染物,若将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:______、______
(3)步骤②酸浸过程中,需要用到3mol·L-1的盐酸100mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有_________
(4)步骤④加入物质X的目的是_____,物质X可以选用下列物质中的_____。
A.氢氧化钠 B.稀盐酸 C.氨水 D.氧化铜
(5)当溶液中金属离子浓度低于1×10-5 mol·L-1时,认为该金属离子沉淀完全,则Ksp[Fe(OH)2]= _____。
(15分)某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O 晶体。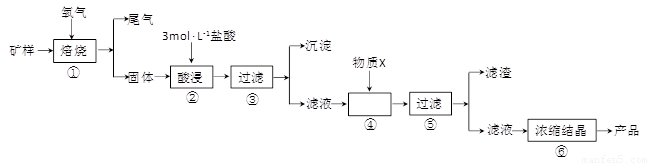
已知:常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
|
金属离子 |
氢氧化物开始沉淀的pH |
氢氧化物沉淀完全的pH |
|
Fe2+ |
7.0 |
9.0 |
|
Fe3+ |
1.9 |
3.2 |
|
Cu2+ |
4.7 |
6.7 |
回答下列问题:
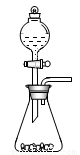
(l)步骤①的焙烧过程中需要通入氧气。在实验室中,可使用常见化学物质利用上图所示装置制取氧气,试写出熟悉的符合上述条件的两个化学方程式:______________________、______________________。
(2)焙烧产生的尾气中含有的一种气体是形成酸雨的污染物,若将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:____________________、__________________。
(3)步骤②酸浸过程中,需要用到3 mol · L-1的盐酸100 mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有_______________________________________。
(4)步骤④加入物质X的目的是_________________________________________,物质X 可以选用下列物质中的______________________。
(A)氢氧化钠 (B)稀盐酸 (C)氨水 (D)氧化铜
(5)当溶液中金属离子浓度低于1×10-5 mol · L-1时,认为该金属离子沉淀完全,则Ksp[Fe(OH)2]=_____。
某矿样含有大量的CuS、少量铁的氧化物及少量其他不溶于酸的杂质。某化学课外小组设计以下流程,以该矿样为原料生产CuCl2·2H2O晶体。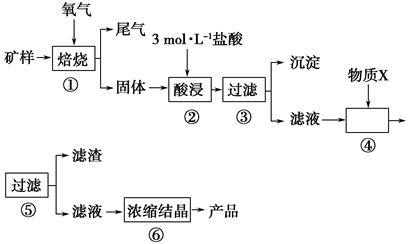
已知:在20 ℃时,氯化铜的溶解度是73 g;常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
| 金属离子 | 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
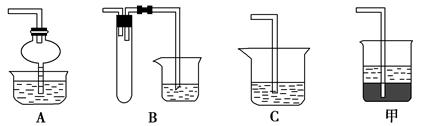
| 化学式 | 沉淀完全时的pH | 钴镍性质 | ||
| Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3?H2O=Co(OH)2↓+2NH
Ni+2HCl=NiCl2+H2↑ Co2++2H2O?Co(OH)2+2H+ Ni2++6NH3?H2O=[Ni(NH3)6]2++6H2O | ||
| Fe(OH)2 | 9.6 | |||
| Fe(OH)3 | 3.7 |
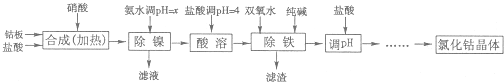
| 加NH3?H2O调PH | 收率/% | Ni2+含量/% |
| 9 | 98.1 | 0.08 |
| 9.5 | 98 | 0.05 |
| 10 | 97.6 | 0.005 |
| 10.3 | 94 | 0.005 |
| 金属离子 | 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| ||
| ||

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com