
题目列表(包括答案和解析)

(14分)
室温下,已知HCl溶液与NaOH溶液的酸碱滴定曲线如下图所示:

(1)向一定量的NaOH溶液中滴加HCl溶液的曲线为图中 (填“实线”或“虚线”)。
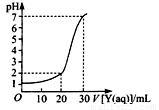
(2)上图为对10mL一定物质的量浓度的NaHSO4溶液X用一定物质的量浓度的氢氧化钠溶液Y滴定的图象,依据图象推出X和Y的物质的量浓度分别是 和 。
(3)某研究性学习小组的研究课题:食醋中总酸量(g/100mL)的测定。他们进行以下滴定操作:
A.取某品牌白醋25.00mL置于 (填仪器名称)中,用蒸馏水稀释10倍。
B.用 (填仪器名称)量取稀释后的白醋溶液20.00mL,置于250mL锥形瓶中,滴入 (填指示剂名称)1~2滴。
C.用0.05 mol·L−1NaOH标准溶液滴定,至终点。记下初始与终点读数。
(注意:滴定重复进行3次。)
根据以上操作,请你继续回答下列问题。
①操作(C)中,滴定时,两眼注视 ;终点现象是 。
②误差分析:下列操作中能使测定结果偏高的是 。
a.稀释白醋的蒸馏水预先未经过煮沸处理
b.盛NaOH溶液的碱式滴定管未用标准液润洗
c.滴定前读数正确,滴定终点时俯视读数
d.接近终点时,用少量蒸溜水洗涤锥形瓶
③如果该小组检测结果与该品牌商标上所注不一致,可能的原因之一是 。
(14分)
室温下,已知HCl溶液与NaOH溶液的酸碱滴定曲线如下图所示:
(1)向一定量的NaOH溶液中滴加HCl溶液的曲线为图中 (填“实线”或“虚线”)。
(2)上图为对10mL一定物质的量浓度的NaHSO4溶液X用一定物质的量浓度的氢氧化钠溶液Y滴定的图象,依据图象推出X和Y的物质的量浓度分别是 和 。
(3)某研究性学习小组的研究课题:食醋中总酸量(g/100mL)的测定。他们进行以下滴定操作:
A.取某品牌白醋25.00mL置于 (填仪器名称)中,用蒸馏水稀释10倍。
B.用 (填仪器名称)量取稀释后的白醋溶液20.00mL,置于250mL锥形瓶中,滴入 (填指示剂名称)1~2滴。
C.用0.05 mol·L−1NaOH标准溶液滴定,至终点。记下初始与终点读数。
(注意:滴定重复进行3次。)
根据以上操作,请你继续回答下列问题。
①操作(C)中,滴定时,两眼注视 ;终点现象是 。
②误差分析:下列操作中能使测定结果偏高的是 。
a.稀释白醋的蒸馏水预先未经过煮沸处理
b.盛NaOH溶液的碱式滴定管未用标准液润洗
c.滴定前读数正确,滴定终点时俯视读数
d.接近终点时,用少量蒸溜水洗涤锥形瓶
③如果该小组检测结果与该品牌商标上所注不一致,可能的原因之一是 。
(14分)
室温下,已知HCl溶液与NaOH溶液的酸碱滴定曲线如下图所示: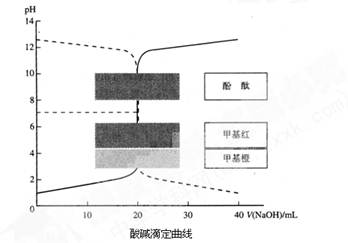
(1)向一定量的NaOH溶液中滴加HCl溶液的曲线为图中 (填“实线”或“虚线”)。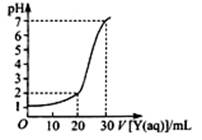
(2)上图为对10mL一定物质的量浓度的NaHSO4溶液X用一定物质的量浓度的氢氧化钠溶液Y滴定的图象,依据图象推出X和Y的物质的量浓度分别是 和 。
(3)某研究性学习小组的研究课题:食醋中总酸量(g/100mL)的测定。他们进行以下滴定操作:
A.取某品牌白醋25.00mL置于 (填仪器名称)中,用蒸馏水稀释10倍。
B.用 (填仪器名称)量取稀释后的白醋溶液20.00mL,置于250mL锥形瓶中,滴入 (填指示剂名称)1~2滴。
C.用0.05 mol·L?1NaOH标准溶液滴定,至终点。记下初始与终点读数。
(注意:滴定重复进行3次。)
根据以上操作,请你继续回答下列问题。
①操作(C)中,滴定时,两眼注视 ;终点现象是 。
②误差分析:下列操作中能使测定结果偏高的是 。
a.稀释白醋的蒸馏水预先未经过煮沸处理
b.盛NaOH溶液的碱式滴定管未用标准液润洗
c.滴定前读数正确,滴定终点时俯视读数
d.接近终点时,用少量蒸溜水洗涤锥形瓶
③如果该小组检测结果与该品牌商标上所注不一致,可能的原因之一是 。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com