
题目列表(包括答案和解析)
 (2012?揭阳一模)某校研究性学习小组探究Cu的常见化合物性质,过程如下:
(2012?揭阳一模)某校研究性学习小组探究Cu的常见化合物性质,过程如下:| 编号 | 实验操作 | 实验现象 | 结论 |
| ① | 用药匙取少许样品,加入试管A中,再用滴管取过量 |
有固体剩余,并有气泡产生 | 合金中除铝外还含有Fe、Cu 元素 |
| ② | 往试管A的剩余固体中加过量 |
固体部分溶解,并有气体放出,溶液呈浅绿色 | |
| ③ | 往试管B中加入少量 |
||
| ④ | 往②剩余固体中加入稀硝酸;再滴加 |
固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色;再加某溶液后有蓝色沉淀产生 |
某化学兴趣小组同学在馓“证明海带中存在碘元素”的实验时,对课本上的描述:“海带灼烧后的灰烬中碘元素以I-形式存在”产生了疑问。久置KI固体被氧化变质,呈浅黄色(有I2),KI固体直接加热时,为什么不被氧化呢?因此,小组同学针对I-被氧化条件除了氧气之外还需要什么条件进行了实验探究。
【提出假设】根据久置KI固体会被氧化而变质,结合空气的成分,首先排除 和稀有气体的影响。然后对KI变质条件提出合理假设:
假设一:需要H2O的参与;
假设二:需要CO2的参与;
假设三: 。
【实验验证】
(1)为了验证假设二,小组同学设计了以下实验方案;取10mLKI溶液(浓度较大)于5支试管中,向试管中通入CO2气体或者滴加盐酸。一段时间后对比试管中的颜色深浅,之后向试管中滴入淀粉溶液,再次对比试管中的颜色深浅,具体实验现象见下表:
|
试管序号 |
1 |
2 |
3 |
4 |
5 |
|
通入CO2时间/min |
0 |
1 |
5 |
|
|
|
滴加盐酸/滴 |
0 |
|
|
3 |
6 |
|
溶液中颜色对比 |
无色 |
浅黄色→黄色(依次加深) |
|||
|
滴加淀粉溶液后的颜色对比 |
无色 |
浅蓝色→蓝色(依次加深) |
小组同学通过实验现象深入思考了CO2在反应过程中的作用,得出结论:CO2气体同盐酸一样在KI被氧化的过程中提供 环境。
写出此实验中CO2与KI反应的化学方程式 。
(2)为了验证I-被氧化是否必须要有H2O的参与,小组同学设计了以下实验验证:
|
实验步骤 |
预期现象和结论 |
|
①取一份纯净的KI固体,分成两等份; |
|
|
②一份加入到装有 的集气瓶A中; 一份加入到装有 的集气瓶A中; ③几天后观察。 |
|
【交流提高】
由于空气中CO2和水蒸气的含量很低,导致在加热KI的过程中这两种气体很容易被“驱散”,不能很好地与KI接触,KI自然就不能被氧化。长时间保存碘化钾需要避光、 。
(12分)某校化学研究性学习小组在学习了金属的知识后,探究Cu的常见化合物的性质。过程如下:
【提出问题】
①在周期表中,Cu、Al位置接近。Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
③Cu0有氧化性,能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有CuSO4溶液、 、 (填试剂名称),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取98 g Cu(OH)2固体,加热至80—100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72 g,则A的化学式为 。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。
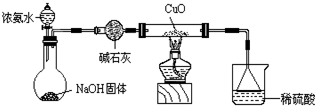
(3)为解决问题③,设计的实验装置为(夹持及尾气处理装置未画出):

实验中观察到Cu0变为红色物质。查资料可知,同时生成一种无污染的气体。
【实验结论】
(1)Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是 。
(2)根据实验方案(2),得出的+1价Cu相+2价Cu稳定性大小的结论是:在高温时 。在酸性溶液中 。
(3)CuO能够被NH3还原。
【问题讨论】
有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应后生成的红色物质中是否含有A?
在一次实验中,某同学把铝片分别放入稀盐酸、稀硫酸中,发现铝片与稀盐酸反应的现象非常明显,而与稀硫酸几乎不反应。这和课本中“铝能跟稀盐酸或稀硫酸反应生成氢气”的说法不一致。为了排除因试剂变质等因素造成的影响,该同学在老师的指导下重新进行了下列实验,验证是否存在上述现象。
【药品】3.0mol?L-1盐酸、1.5mol?L-1硫酸、3.0mol?L-1硫酸、相同大小的铝片(纯度>99.5%)
【实验过程】往三支相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol?L-1盐酸、1.5mol?L-1硫酸、3.0mol?L-1硫酸。观察反应进行到1、2、5、15、20min时铝与酸反应的情况。其结果如下:
通过上述实验可知,无论是用1.5mol?L-1H2SO4还是3.0mol?L-1H2SO4均无明显现象,
而3.0mol?L-1盐酸与铝片反应的现象却十分明显。
【提出问题】
(1)写出铝与酸反应的离子方程式:_____。
(2)反应1~15min内,铝与盐酸反应的反应速率逐渐加快,其原因是___________________。
(3)根据以上探究,你能对“铝与稀盐酸和稀硫酸反应差异的原因”作出哪些假设或猜想(列出两种即可)?
①___________________。
②___________________。
(4)为了验证上述假设,你设计的实验方案是___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com