
题目列表(包括答案和解析)
Ⅰ.某校化学课外小组用硫酸铁废液(含少量硫酸铜和稀硫酸),制备硫酸亚铁晶体并进行如下实验。制备硫酸亚铁晶体主要的操作流程如下:
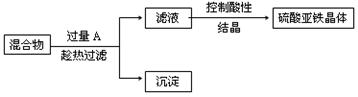
请根据题目要求回答下列问题:
(1)趁热过滤的目的是 。
(2)加入过量A,溶液中发生的离子方程式有 。
(3)结晶操作过程中应控制滤液酸性的原因是 ,结晶析出晶体后,用过滤的方法从溶液得到晶体,洗涤晶体的实验操作是 。
(4)实验室利用硫酸亚铁溶液和草酸溶液反应生成草酸亚铁沉淀来制备草酸亚铁。写出该反应的离子方程式 。
Ⅱ.草酸亚铁晶体(FeC2O4·2H2O,相对分子质量180)受热易分解,某课外小组设计如图的实验装置来检验其分解产物。
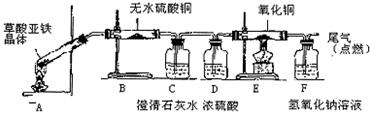
(5)该装置中最不合理的部分__________(填字母),原因是__________________________。
(6)写出B、C处的现象___________________________________________。
(7)当72.0g FeC2O4·2H2O完全反应后,残留混合物质量为27.2g,无水硫酸铜增重14.4g,C装置增重22.0g。求残留混合物的成分和物质的量 。(假设每个实验装置的药品足量,气体被充分吸收)




A、B、C、D、E、F、G、H的转化关系如下图。已知A是一种盐,B、C为常见的金属。常温常压下D为无色无味气体,无色气体G遇空气变红棕色。用惰性电极电解A溶液一段时间后,产物只有C、D和E的稀溶液。

请回答下列问题:
(1)A的化学式为 。
(2)A溶液电解的化学方程式为 。
(3)E的稀溶液与F溶液反应的离子方程式 。
(4)电解400mL盐A的溶液一段时间后,断开电路,取出电极,测得所得到的气体D在标准状况下的体积为22.4mL,则电解后溶液的pH为 (假设溶液体积不变)。
(5)若向E的稀溶液中加入12.0g金属单质B和C的混合粉末,固体完全溶解,收集反应产生的气体,再向所得溶液中加入足量的氢氧化钠溶液,产生20.5g沉淀。则收集气体的物质的量是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com