
题目列表(包括答案和解析)
 6CaSiO3+P4O10 10C+P4O10
6CaSiO3+P4O10 10C+P4O10 P4+10CO
P4+10CO C6H6O6+2H++2I- 2
C6H6O6+2H++2I- 2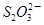 +I2
+I2
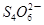 +2I-在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2, 消耗b mol·L-1Na2S2O3溶液V2mL。该溶液中维生素C的物质的量是___________mol。
+2I-在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2, 消耗b mol·L-1Na2S2O3溶液V2mL。该溶液中维生素C的物质的量是___________mol。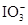 +5
+5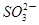 +2H+
+2H+ I2+5
I2+5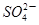 +H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
+H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示: 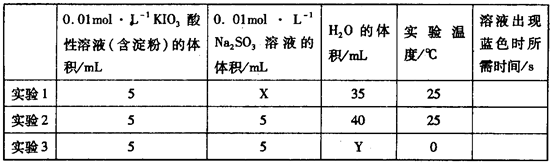
 Ce3++
Ce3++ H2O2+
H2O2+ H2O
H2O
 Ce(OH)4↓+
Ce(OH)4↓+ ______________
______________



| 实验步骤 | 实验现象 | 实验结论 |
| ①______ | ______ | 溶液X中含有钠离子 |
| ②______ | ______ | 溶液X中含有氯离子 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com