
题目列表(包括答案和解析)
(16分)某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】制作银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关利用Fe粉与稀HNO3制备Fe(NO3)3溶液的方法,最佳的是 。
a.把过量的铁粉与稀HNO3反应
b.把铁粉与过量的稀HNO3反应
c.先把铁粉灼烧,再溶解于稀HNO3 中
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学为了验证假设1,取上述实验后的溶液,检验Fe2+。检验Fe2+的方法: ,甲同学观察到的实验现象为: ,甲同学检验出Fe2+,验证了假设1的成立。请写出Fe3+氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2。请写出在酸性条件下NO3-氧化Ag的离子方程式: 。并帮乙同学完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生,乙同学放弃了检验NO3-在不同条件下的还原产物的方法)。
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ①测定上述实验用的Fe(NO3)3溶液的pH值 | |
| ② |
(16分)某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】制作银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关利用Fe粉与稀HNO3制备Fe(NO3)3溶液的方法,最佳的是 。
a.把过量的铁粉与稀HNO3 反应
b.把铁粉与过量的稀HNO3 反应
c.先把铁粉灼烧,再溶解于稀HNO3 中
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学为了验证假设1,取上述实验后的溶液,检验Fe2+。检验Fe2+的方法: ,甲同学观察到的实验现象为: ,甲同学检验出Fe2+,验证了假设1的成立。请写出Fe3+氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2。请写出在酸性条件下NO3-氧化Ag的离子方程式: 。并帮乙同学完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生,乙同学放弃了检验NO3-在不同条件下的还原产物的方法)。
|
实验步骤(不要求写具体操作过程) |
预期现象和结论 |
|
①测定上述实验用的Fe(NO3)3溶液的pH值 |
|
|
② |
(12分)前四周期元素X、Y、Z、W核电荷数依次增加,核电荷数之和为58;Y 原子的M层p轨道有3个未成对电子;Z与Y同周期,且在该周期中电负性最大;W原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶2。
(1)X的元素符号为_______,Z元素位于周期表第_______周期第________族。
(2)Y与X形成共价化合物A,Z与X形成共价化合物B,A与B还原性较强的是________(写分子式)。
(3)Z的最高价氧化物的水化物的化学式为________________。
(4)12.4 g单质Y4与0.3 mol O2在一定条件下恰好完全反应生成0.1 mol化合物C,一个C分子中所含有的 键数目为 。
键数目为 。
(5)含W元素的最高化合价的含氧酸根离子是___________,该含氧酸根离子在分析化学中有重要作用,请写出在酸性条件下该含氧酸根离子与Fe2+反应的离子方程式:
______________________________________________________________________。
前四周期元素X、Y、Z、W核电荷数依次增加,核电荷数之和为58;Y 原子的M层p轨道有3个未成对电子;Z与Y同周期,且在该周期中电负性最大;W原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶2。
X的元素符号为_______,Z元素位于周期表第_______周期第________族。
Y与X形成共价化合物A,Z与X形成共价化合物B,A与B还原性较强的是________(写分子式)。
Z的最高价氧化物的水化物的化学式为________________。
12.4 g单质Y4与0.3 mol O2在一定条件下恰好完全反应生成0.1 mol化合物C,一个C分子中所含有的![]() 键数目为 。
键数目为 。
含W元素的最高化合价的含氧酸根离子是___________,该含氧酸根离子在分析化学中有重要作用,请写出在酸性条件下该含氧酸根离子与Fe2+反应的离子方程式:
______________________________________________________________________。
甲状腺激素对于人和高等动物具有极其重要的生理作用。下图是关于碘及其化合物与甲状腺激素的转化网络图。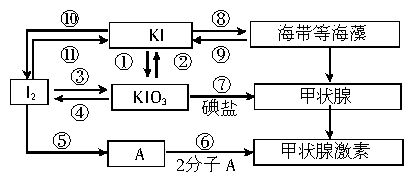
(1)请写出在酸性条件下,由KI和KIO3反应制得I2的离子方程式___________________。
(2)上述反应①②③④⑩{11}中,碘元素发生氧化反应的是_______________(填序号)。
(3)制备KIO3的方法较多,反应③的原理是I2在一定条件下还原KClO3制得KIO3,写出该反应的化学方程式:_______________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com