(1)在-50℃时,液氨存在如下电离:2NH
3?NH
4++NH
-2,k=2×10
-12,液氨的电离达到平衡时,各微粒的浓度大小关系为______,加入NH
4Cl固体,K______2×10
-12(填“<”、“>”或“=”)
(2)已知25℃时Ksp(AgCl)=1.8×10
--10,在10mL 0.10mol/L AgNO
3溶液中加入10mL0.20mol/LNaCl溶液,充分反应后溶液中的c(Ag
+)=______.
(3)配平硫酸亚铁加强热制备铁红和生成硫的两种常见氧化物的化学方程式:
______FeSO
4______Fe
2O
3+____________+____________
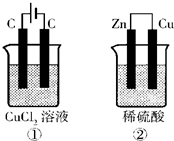
(4)已知氯气能溶于水,溶液呈酸性.如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是______
A.产生气体的体积:①>②
B.溶液的pH变化:①减小,②增大
C.电极上析出物质的质量:①>②
D.电极反应式:①中阳极 2Cl
--2e
-?Cl
2↑ ②中负极 2H
++2e
-?H
2↑

 ______Fe2O3+____________+____________
______Fe2O3+____________+____________