
题目列表(包括答案和解析)
下面是某化学学习小组的实验记录,请根据实验记录(部分需要补充)回答有关问题。
【研究课题】铜离子颜色的探究
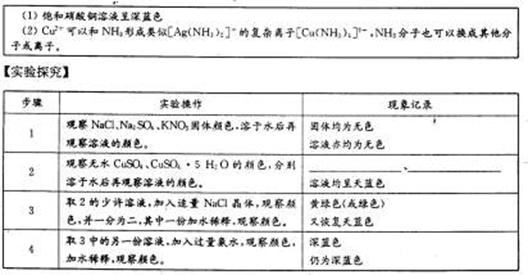 【资料卡片】
【资料卡片】
【交流讨论】
(1)以上所得溶液或物质呈天蓝色的化学粒子符号是 (写化学式,下同);实验步骤4中呈深蓝色的化学粒子符号是 ;使饱和硝酸铜溶液呈深蓝色的化学粒子符号可能是 。
(2)请写出实验步骤3中“其中一份加水稀释”的反应离子的方程式: 。
(3)有资料上介绍浓硝酸与铜丝反应后得溶液颜色显蓝色,实验中得到却是绿色溶液,试写出显绿色的可能原因 ,设计两种不同的简单的实验方法证明你的解释:
方案① ;
方案② 。
硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了NazS04中的一个O原子而
形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学
性质。
【提出问题】Na2S2O3是否与Na2S2O4相似而具备下列性质呢?
猜想①:溶液呈中性,且不与酸反应;
猜想②:无还原性,不能被氧化剂氧化。
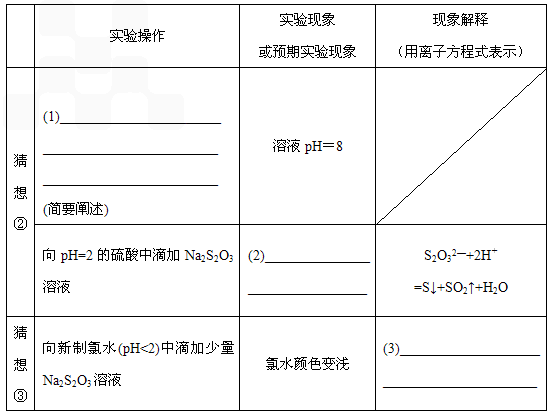
【实验探究】基于上述猜想①②,设计实验方案。
| 实验操作过程 | 实验现象或 预期实验现象 | 现象解释 (用离子方程式表示) | |
|
▲ |
溶液pH=8 |
| |
| 猜想① | 向Ph=2的硫酸中滴加 Na2S2O3溶液 | ▲ |
|
| 猜想② | 向新制氯水(pH<2)中滴 加少量Na2S2O3溶液 | 氯水颜色变浅 | ▲ |
【实验结论】Na2S2O3能与酸反应,具有还原性,与Na2S2O4的化学性质不相似。
【问题讨论】
(1)甲同学取探究“猜想②”反应后的溶液少量,滴加硝酸银溶液,观察到有白色沉淀并
据此认为氯水可将Na2S2O3氧化。你认为该方案是否合理并说明理由 ▲ 。
(2)若方案不合理,请你设计一个实验方案,证明Na2S2O3。被氯水氧化 ▲ 。
硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了NazS04中的一个O原子而
形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学
性质。
【提出问题】Na2S2O3是否与Na2S2O4相似而具备下列性质呢?
猜想①:溶液呈中性,且不与酸反应;
猜想②:无还原性,不能被氧化剂氧化。
【实验探究】基于上述猜想①②,设计实验方案。
| 实验操作过程 | 实验现象或 预期实验现象 | 现象解释 (用离子方程式表示) | |
|
▲ |
溶液pH=8 |
| |
| 猜想① | 向Ph=2的硫酸中滴加 Na2S2O3溶液 | ▲ |
|
| 猜想② | 向新制氯水(pH<2)中滴 加少量Na2S2O3溶液 | 氯水颜色变浅 | ▲ |
【实验结论】Na2S2O3能与酸反应,具有还原性,与Na2S2O4的化学性质不相似。
【问题讨论】
(1)甲同学取探究“猜想②”反应后的溶液少量,滴加硝酸银溶液,观察到有白色沉淀并
据此认为氯水可将Na2S2O3氧化。你认为该方案是否合理并说明理由 ▲ 。
(2)若方案不合理,请你设计一个实验方案,证明Na2S2O3。被氯水氧化 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com