
题目列表(包括答案和解析)


| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN溶液 |
溶液为红色 溶液为红色 |
固体物质中有FeCl3 |
| 向a溶液中滴加 酸性KMnO4溶液 |
KMnO4溶液紫色 不褪色 |
固体物质中不含 固体物质中不含 FeCl2 固体物质中不含 FeCl2 |
 某校甲、乙、丙三个化学兴趣小组利用课外活动时间,设计了不同的课题分别进行了实验探究活动:
某校甲、乙、丙三个化学兴趣小组利用课外活动时间,设计了不同的课题分别进行了实验探究活动: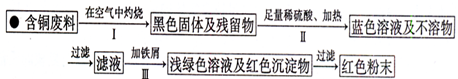

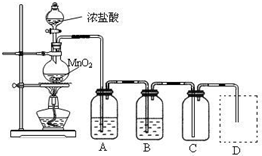
(18分)某中学化学课外活动小组欲探究铁在氯气中燃烧产物的成份、性质和用途,设计了如下实验步骤:
Ⅰ、用下列实验装置制取纯净干燥的氯气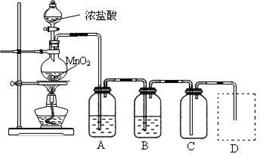
写出A、B中所盛放最佳化学试剂的名称 、 ,画出虚线框内所需装置图并标明所需试剂的名称。
Ⅱ、某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质a,然后通过实验确定其成分。探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设①:该固体物质是FeCl3;假设②: ;假设③: 。
(2)设计实验方案:
取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论如下表,请在表格内的横线处填空。
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN溶液 | | 固体物质中有FeCl3 |
| 向a溶液中滴加 酸性KMnO4溶液 | KMnO4溶液紫色 不褪色 | 固体物质中不含______ |
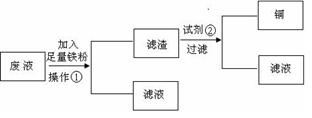
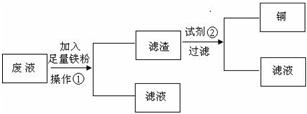
某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子。以下是某化学研究性学习小组的同学设计的除去污水中的金属离子,回收绿矾、皓矾(ZnSO4·7H2O)和汞的方案。
[药品] NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
[实验方案]
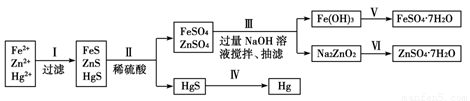
[问题探究]
(1)步骤Ⅱ所发生反应的离子方程式为_________________________________________________。
(2)步骤Ⅲ中的抽滤为减压条件下的过滤,可以加快过滤速度;该步骤涉及反应的离子方程式有Zn2++4OH-=ZnO22-+2H2O和________________。
(3)步骤Ⅵ中得到硫酸锌溶液的离子反应方程式为______________________________。
(4)欲实现步骤Ⅴ,所需加入的试剂有________、________,所涉及的主要操作依次为______________________。
(5)步骤Ⅳ常用的方法是加热,该步骤是否对环境有影响?__________(填“是”或“否”),如有影响,请你设计一个环境保护方案来实现步骤Ⅳ的反应________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com