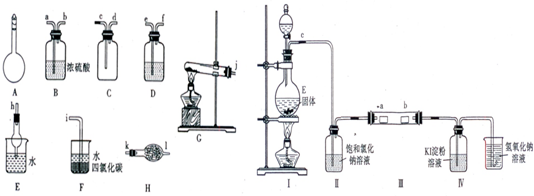
Ⅰ.同学甲选用下图所示仪器制备少量无水FeCl
3,仪器连接顺序正确的是:
a→e→d→
c
c
→
b
b
→
h
h
→
j
j
→
g
g
.

Ⅱ.同学乙善于利用类比的方法学习,他根据已知资料:硝酸能把铁氧化成Fe(NO
3)
3,但当铁过量时,产物是Fe(NO
3)
2.提出一个相似的观点:氯气与铁粉反应,当C1
2足量时生成FeCl
3,当铁粉过量时产物是FeCl
2.为验证该观点是否正确,他将一根细的纯铁丝分别在足量和少量的Cl
2中点燃,取其表面生成物并分别编号为A、B,然后通过实验确定其成分.探究过程如下:
(1)提出假设:A是FeCl
3;B是FeCl
2.
(2)设计实验方案:分别取A、B的溶液均进行以下实验.请填写下表中的相应空格.
| 实验方法 |
实验现象 |
结论 |
| 分别向A、B溶液中加KSCN溶液 |
溶液变红色 溶液变红色 |
固体物质中含有FeCl3 |
| 分别向KMnO4溶液中加入适量A、B溶液 |
KMnO4溶液颜色无明显变化 |
固体物质中不含 FeCl2 FeCl2 |
(3)根据上述实验结论,写出Cl
2与铁粉加热时发生反应的化学方程式:
;
(4)实际应用:FeCl
3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有FeCl
3、FeCl
2、CuCl
2,同学们设计了从废液中回收Cu的方案:向废液中加入过量的铁粉,充分反应后,过滤.在所得滤渣中加入足量的盐酸,充分反后,再过滤即得到铜.该方案涉及的四种阳离子的氧化性由强到弱的顺序为:
Fe3+>Cu2+>H+>Fe2+
Fe3+>Cu2+>H+>Fe2+
;请写出该方案涉及的反应的离子方程式:
2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu、2Fe3++Cu=2Fe2++Cu2+、Fe+2H+=Fe2++H2↑
2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu、2Fe3++Cu=2Fe2++Cu2+、Fe+2H+=Fe2++H2↑
.

 Ⅰ.下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内.
Ⅰ.下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内.