
题目列表(包括答案和解析)
| 实验方案 | 实现现象 | 结论 |
| 1取一定量的合金粉末,加过量的 |
粉末部分溶解,并有气体放出. | 合金中一定含有 |
| ②取步骤①所得滤渣,加过量的 |
滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有 |
华素片(西地碘片)使用说明书 【品名和组成】 品名:西地碘片 组成:华素片 英文名:Cydiodine Tablets 华素片(西地碘片)的主要活性成分是分子碘,含量1.5 mg/片。将碘利用分子分散技术制成分子态西地碘,并含适量薄荷脑等 【贮藏】 遮光、密闭、在凉处保存 【有效期】 二年 |
(1)根据上述说明和所学知识回答:
①华素片中含有的活性成分是______________(写分子式)。
②请推断华素片______________(“是”或“不是”)白色。
(2)某学生为验证华素片中确实含有上述成分,完成实验如下,请填空:
①取一粒药片放入研钵中研碎,再将药粉装入试管并加入约2 mL蒸馏水;向试管中再加入约2 mL______________(填选项字母),并用力振荡。
A.酒精(密度比水小,与水任意比混溶)
B.四氯化碳(密度比水大,不溶于水)
②描述加入该液体后可能观察到的现象________________________________。
③选用该液体的原因是________________________________________。
(3)请再设计另一种方法,验证华素片中的成分(注意叙述实验原理,操作方法和实验结论)________________________________。
(16分)为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案。请回答每个方案中提出的问题。
【方案I】
(1)称取碳酸钙样品M g;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积V mL。
问题1:反应结束后,量气管中的显示如右图所示,接下来的操作是: ,读出甲管中液面的读数。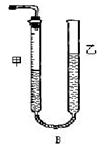
【方案II】
(1)称取碳酸钙样品M g;
(2)用c mol/L 盐酸V mL(过量)溶解样品;
(3)取溶解后的溶液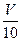 mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
问题2:列出本实验中所用到的主要仪器名称(除铁架台及附件、烧杯之外) 。
问题3:碳酸钙纯度计算公式 。
问题4:当碳酸钙溶解完全后,少量未溶的SiO2没过滤去,结果得到碳酸钙纯度________ (偏大、偏小或无影响)
【方案Ⅲ】
(1)称取碳酸钙样品M g;
(2)加入足量c mol/L盐酸V mL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量c′ mol/L Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g。
问题5:此方案中不需要的数据是 (填选项编号)。
| A.c、V | B.c′、 V′ | C. M′ | D. M |
(16分)为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案。请回答每个方案中提出的问题。
【方案I】
(1)称取碳酸钙样品 M g;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积 V mL。
问题1:反应结束后,量气管中的显示如右图所示,接下来的操作是: ,读出甲管中液面的读数。
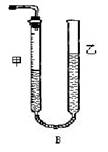
【方案II】
(1)称取碳酸钙样品 M g;
(2)用c mol/L 盐酸 V mL(过量)溶解样品;
(3)取溶解后的溶液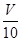 mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
问题2:列出本实验中所用到的主要仪器名称(除铁架台及附件、烧杯之外) 。
问题3:碳酸钙纯度计算公式 。
问题4:当碳酸钙溶解完全后,少量未溶的SiO2没过滤去,结果得到碳酸钙纯度________ (偏大、偏小或无影响)
【方案Ⅲ】
(1)称取碳酸钙样品 M g;
(2)加入足量c mol/L盐酸V mL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量c′ mol/L Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g。
问题5:此方案中不需要的数据是 (填选项编号)。
A.c、V B.c′、 V′ C. M′ D. M
问题6:为减少实验误差,步骤(3)、(5)过滤后都要对沉淀进行洗涤,如果步骤(3)未经洗涤,则测定的碳酸钙的纯度将 (偏大、偏小、无影响,下同);如果步骤(5)未经洗涤,则测定的碳酸钙纯度将 。
问题7:判断步骤(4)中Na2CO3溶液是否过量的方法是 。
在一次实验中,某同学把铝片分别放入稀盐酸、稀硫酸中,发现铝片与稀盐酸反应的现象非常明显,而与稀硫酸几乎不反应。这和课本中“铝能跟稀盐酸或稀硫酸反应生成氢气”的说法不一致。为了排除因试剂变质等因素造成的影响,该同学在老师的指导下重新进行了下列实验,验证是否存在上述现象。
【药品】3.0mol?L-1盐酸、1.5mol?L-1硫酸、3.0mol?L-1硫酸、相同大小的铝片(纯度>99.5%)
【实验过程】往三支相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol?L-1盐酸、1.5mol?L-1硫酸、3.0mol?L-1硫酸。观察反应进行到1、2、5、15、20min时铝与酸反应的情况。其结果如下:
通过上述实验可知,无论是用1.5mol?L-1H2SO4还是3.0mol?L-1H2SO4均无明显现象,
而3.0mol?L-1盐酸与铝片反应的现象却十分明显。
【提出问题】
(1)写出铝与酸反应的离子方程式:_____。
(2)反应1~15min内,铝与盐酸反应的反应速率逐渐加快,其原因是___________________。
(3)根据以上探究,你能对“铝与稀盐酸和稀硫酸反应差异的原因”作出哪些假设或猜想(列出两种即可)?
①___________________。
②___________________。
(4)为了验证上述假设,你设计的实验方案是___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com