
题目列表(包括答案和解析)
元素及其化合物在生产、生活中具有广泛的用途。
Ⅰ.铬化学丰富多彩.
(1)在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液。 与铜相比,其金属活泼性?????? (填“强”或“弱”);
⑵Cr( OH)3和Al( OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡,其酸式电离方程式是?????????????????????????? ;
⑶工业上净化处理铬污染方法之一是:将含K2Cr2O7酸性废水放人电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知KsP[ Fe(OH)3]=4.0×10-38,KsP[Cr(OH)3]=6.0×l0-31)。已知电解后的溶液中c( Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为??????????? mol/L。
Ⅱ.物质A~H有如图所示转化关系(部分生成物未列出)。A、E、F、G均为气体,D为金属单质。

请回答下列问题:
(1)A的电子式为???????? D的化学式?????????? ,C溶液的名称是??????????????????? 。
(2)反应①的化学方程式为?????????????????????????????? ;
反应③的离子方程式为?????????????????????????????????? 。
(1)现用物质的量浓度为amol/L的标准盐酸去测定VmLNaOH溶液的物质的量浓度,请填写下列空白:
①酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
②下图是酸式滴定管中液面在滴定前后的读数,则被测NaOH溶液的的物质的量浓度为:c(NaOH)= ________________。
③若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测得的NaOH溶液的物质的量浓度会偏_________________。
(2)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。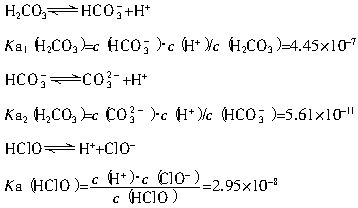
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将过量的氯气通入到少量的碳酸钠溶液中______________________________________;
②氯气和碳酸钠按照1∶1的比例恰好反应_____________________________________。
(3)铬是1979年法国化学家沃克兰在分析铬铅矿时首先发现的。铬位于周期表中第四周期ⅥB族,其主要化合价为+6、+3、+2,其中+3较为稳定。某兴趣小组对铬的化合物进行探究性研究发现:Cr2O3微溶于水,与A12O3类似,是两性氧化物;Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡。Cr(OH)3酸式电离的电离方程式是:_________。
【1】(6分)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S===K2S+N2↑+3CO2↑。其中被还原的元素是(填元素符号) ,被氧化的元素是(填元素符号) ,氧化剂是(填化学式,以下同) ,还原剂是 ,氧化产物是 ,还原产物是 。
【2】(5分)运用比较方法是化学科学中研究物质性质的基本方法之一,请运用比较法解答题 过氧化钠几乎可与所有的常见气态非金属氧化物反应。
如:2Na2O2+2CO2=2Na2CO3+O2↑Na2O2+2CO=Na2CO3。
(1) 试分别写出Na2O2与SO2、SO3反应的化学方程式:
。
(2) 通过比较可知,当非金属元素处于 价时,其氧化物与过氧化钠反应有O2生成。
【1】(6分)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S===K2S+N2↑+3CO2↑。其中被还原的元素是(填元素符号) ,被氧化的元素是(填元素符号) ,氧化剂是(填化学式,以下同) ,还原剂是 ,氧化产物是 ,还原产物是 。
【2】(5分)运用比较方法是化学科学中研究物质性质的基本方法之一,请运用比较法解答题 过氧化钠几乎可与所有的常见气态非金属氧化物反应。
如:2Na2O2+2CO2=2Na2CO3+O2↑Na2O2+2CO=Na2CO3。
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式:
。
(2)通过比较可知,当非金属元素处于 价时,其氧化物与过氧化钠反应有O2生成。
【1】(6分)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S===K2S+N2↑+3CO2↑。其中被还原的元素是(填元素符号) ,被氧化的元素是(填元素符号) ,氧化剂是(填化学式,以下同) ,还原剂是 ,氧化产物是 ,还原产物是 。
【2】(5分)运用比较方法是化学科学中研究物质性质的基本方法之一,请运用比较法解答题过氧化钠几乎可与所有的常见气态非金属氧化物反应。
如:2Na2O2+2CO2=2Na2CO3+O2↑Na2O2+2CO=Na2CO3。
(1) 试分别写出Na2O2与SO2、SO3反应的化学方程式:
。
(2) 通过比较可知,当非金属元素处于 价时,其氧化物与过氧化钠反应有O2生成。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com