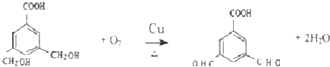
(2009?广州二模)乙酸乙酯是重要的化工原料,沸点约77℃.其水解反应方程式为CH
3COOC
2H
5+H
2O?CH
3COOH+C
2H
5OH酸和碱均可用作该反应的催化剂.某兴趣小组对NaOH溶液催化乙酸乙酯水解进行了探究.
实验步骤:
向试管中加入8mLNaOH溶液,再加入2mL乙酸乙酯,用直尺量出乙酸乙酯的高度.再把试管放入70℃的水浴中,每隔1min将其取出,振荡,静置,立即测量并记录剩余酯层的高度.再迅速放回水浴中继续加热,如此反复进行.改变NaOH溶液浓度,重复实验.
数据记录:
乙酸乙酯水解后剩余的高度/min
| 组别 |
C(NaOH)/mol?L-1 |
时间/min |
| 0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| 1 |
0.5 |
10.0 |
9.0 |
8.0 |
7.5 |
7.0 |
6.5 |
6.5 |
6.5 |
6.5 |
| 2 |
1.0 |
10.0 |
8.5 |
7.0 |
6.0 |
5.0 |
4.5 |
4.5 |
4.5 |
4.5 |
| 3 |
2.0 |
10.0 |
8.0 |
6.0 |
4.5 |
3.0 |
2.0 |
1.5 |
1.5 |
1.5 |
回答下列问题:
(1)完成上述对比实验时,每组实验都必须控制不变的因素有
NaOH溶液的体积乙酸乙酯的用量
NaOH溶液的体积乙酸乙酯的用量
、
反应温度
反应温度
.
(2)分析上述数据,得到乙酸乙酯水解速率的结论是:
①NaOH溶液浓度越大,水解速率越
快
快
②
乙酸乙酯水解速率先快后慢,一段时间后停止水解
乙酸乙酯水解速率先快后慢,一段时间后停止水解
.
(3)结论②的理论解释是
NaOH能与水解产物醋酸发生中和反应,随着反应的进行,NaOH浓度逐渐减小直到完全消耗,其催化作用也逐渐减弱直到没有催化作用
NaOH能与水解产物醋酸发生中和反应,随着反应的进行,NaOH浓度逐渐减小直到完全消耗,其催化作用也逐渐减弱直到没有催化作用
.
(4)欲使乙酸乙酯完全水解,可采取的措施是
增大NaOH的浓度(或体积)
增大NaOH的浓度(或体积)
.
(5)有同学认为有必要用蒸馏水代替NaOH溶液重复试验,对数据进行修正,主要原因是
乙酸乙酯水解过程中部分挥发
乙酸乙酯水解过程中部分挥发
.






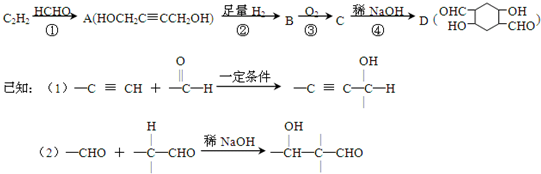


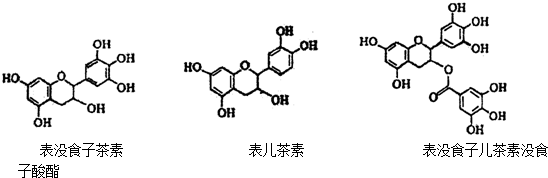
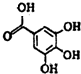
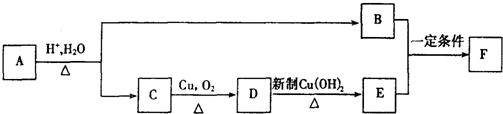
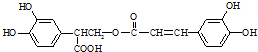 ;它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,以A为原料合成F的路线如下:
;它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,以A为原料合成F的路线如下: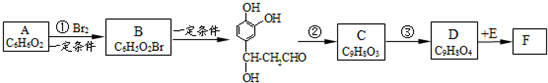
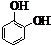

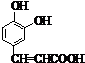

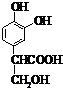
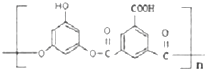
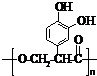 +nH2O
+nH2O
 +nH2O
+nH2O