
题目列表(包括答案和解析)
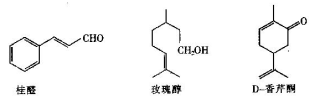
以下几种物质是食用香精的主要成分

(1)以上三种食用香精都含有的官能团为_____________(填名称)。
(2)用于鉴别桂醛和玫瑰醇的试剂为____________________。
(3)写出符合下列条件的桂醛的同分异构体的结构简式________。
a.苯环上连接着两个互为对位的基团
b.有一个甲基
c.能与溴的四氯化碳溶液发生加成反应
d.遇FeCl3,溶液显示特征颜色
(4)已知醛在一定条件下可以两分子加成:

有机物M为芳香族化合物且与D一香芹酮互为同分异构体,其合成路线如下

①试剂X为______________;
②M的结构简式为____________;
③D发生加聚反应的化学方程式为____________________
以下几种物质是食用香精的主要成分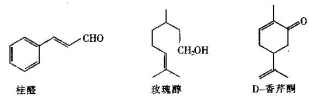
(1)以上三种食用香精都含有的官能团为_____________(填名称)。
(2)用于鉴别桂醛和玫瑰醇的试剂为____________________。
(3)写出符合下列条件的桂醛的同分异构体的结构简式________。
a.苯环上连接着两个互为对位的基团
b.有一个甲基
c.能与溴的四氯化碳溶液发生加成反应
d.遇FeCl3,溶液显示特征颜色
(4)已知醛在一定条件下可以两分子加成: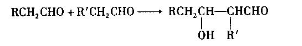
有机物M为芳香族化合物且与D一香芹酮互为同分异构体,其合成路线如下
①试剂X为______________;
②M的结构简式为____________;
③D发生加聚反应的化学方程式为____________________
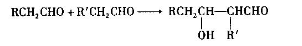

| 元素 | A | B | C | D |
| 性质 结构 信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104s2 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(13分) 四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素 A B C D
性质
结构
信息 原子核外有两个电子层,最外层有3个未成对的电子 原子的M层有1对成对的p电子 原子核外电子排布为[Ar]3d104s1,
有+1、+2两种常见化合价 有两种常见氧化物,其中有一种是冶金工业常用的还原剂
⑴写出B原子的电子排布式 。
⑵A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其是__________________________。
⑶D的最高价氧化物的电子式: 。高温下D的氧化物还原赤铁矿的方程式为可逆反应,写出该反应的化学方程式___________________,该反应的平衡常数表达式K=___________。
⑷往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为________________,简要描述该配合物中化学键的成键情况__________________。
⑸下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
”表示没有形成共价键的最外层电子,短线表示共价键。

则在以上分子中,中心原子采用sp3杂化形成化学键的且空间构型是角形的是 (填写序号);在②的分子中有 个σ键和 个π键。
⑹已知NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为 \s\up10(∣←N-,\s\up10(∣H(→表示共用电子对由N原子单方面提供)。 请画出N4H44+的结构式_____________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com