Ⅰ:碱存在下,卤代烃与醇反应生成醚(R-O-R′):R-X+R′OH
R-O-R′+HX化合物A经下列四步反应可得到常用溶剂四氢 呋喃,反应框图如图一所示:
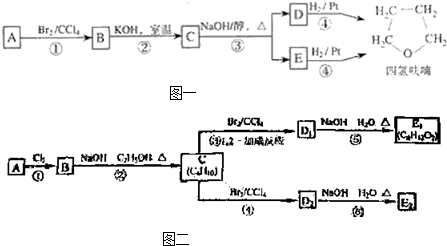
请回答下列问题:
(1)1mol A和1mol H
2在一定条件下恰好反应,生成饱和一元醇Y,Y中碳元素的质量分数约为65%,则Y的分子式为
C4H10O
C4H10O
.A分子中所含官能团的名称是
羟基、碳碳双健
羟基、碳碳双健
.A的结构简式为
CH2=CHCH2CH2OH
CH2=CHCH2CH2OH
.
(2)第①②步反应类型分别为①
加成反应
加成反应
,②
取代反应
取代反应
.
(3)化合物B具有的化学性质(填写字母代号)是
abc
abc
.
a.可发生氧化反应 b.强酸或强碱条件下均可发生消去反应
c.可发生酯化反应 d.催化条件下可发生加聚反应
(4)写出C、D和E的结构简式:C
、D
、E
.
(5)写出化合物C与NaOH水溶液反应的化学方程式:
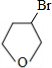
+NaOH
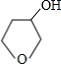
+NaBr

+NaOH

+NaBr
.
(6)写出四氢呋喃链状醚类的所有同分异构体的结构简式:
CH2=CHOCH2CH3、CH2=CHCH2OCH3、CH3CH=CHOCH3、CH2=C(CH3)OCH3
CH2=CHOCH2CH3、CH2=CHCH2OCH3、CH3CH=CHOCH3、CH2=C(CH3)OCH3
.
Ⅱ:某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢.
(1)A的结构简式为
(CH3)2C=C(CH3)2
(CH3)2C=C(CH3)2
;
(2)A中碳原子是否都处于同一平面?
是
是
(填“是”或“不是”);
(3)在图二中,D
1、D
2互为同分异构体,E
1、E
2互为同分异构体.
反应②的化学方程式为
(CH
3)
2C(Cl)C(Cl)(CH
3)
2+2NaOH
CH
2=C(CH
3)-C(CH
3)=CH
2+2NaCl+2H
2O
(CH
3)
2C(Cl)C(Cl)(CH
3)
2+2NaOH
CH
2=C(CH
3)-C(CH
3)=CH
2+2NaCl+2H
2O
;C 的化学名称是
2,3-二甲基-1,3-丁二烯
2,3-二甲基-1,3-丁二烯
;E
2的结构简式是
HOCH2C(CH3)=C(CH3)CH2OH
HOCH2C(CH3)=C(CH3)CH2OH
;④、⑥的反应类型依次是
加成反应
加成反应
;
取代反应
取代反应
.

 Ⅰ:如图表示800℃时,A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答:
Ⅰ:如图表示800℃时,A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答:
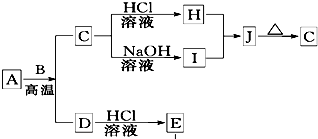 B、D是常见金属单质,A是一种红棕色金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体.
B、D是常见金属单质,A是一种红棕色金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体.






 +NaOH
+NaOH +NaBr
+NaBr +NaOH
+NaOH +NaBr
+NaBr
