
题目列表(包括答案和解析)
已知可逆反应N2O4(g)  2NO2(g)
在873K时,平衡常数K1=1.78×104,转化率为a%,在1273 K时,平衡常数K2 = 2.8×104,转化率为b%,则下列叙述正确的是
2NO2(g)
在873K时,平衡常数K1=1.78×104,转化率为a%,在1273 K时,平衡常数K2 = 2.8×104,转化率为b%,则下列叙述正确的是
A.由于K2>K1,所以a>b
B.由于K随温度升高而增大,所以此反应的△H>0
C.由于K随温度升高而增大,所以此反应的△H<0
D.其它条件不变时,将盛有该混合气体的容器置于热水中,体系颜色变浅
(8分)向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g)? ?xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
?xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示: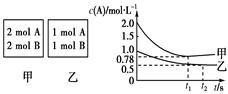
回答下列问题:
(1)乙容器中,平衡后物质B的转化率________;
(2)x=________;
(3)T ℃时该反应的平衡常数为________;
(4)下列说法正确的是________。
A.向平衡后的乙容器中充入氦气可使c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1
1. 醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某校研究性学习小组开展了题为“醋酸是弱电解质的实验研究”的探究活动。该校研究性学习小组设计了如下方案:A.先配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质
B.先测0.10 mol/L CH3COOH溶液的pH,然后将其加热至40℃,再测pH,如果pH变小,则可证明醋酸为弱电解质
C.先配制一定量0.01 mol/L和0.10 mol/L的CH3COOH溶液,分别测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸为弱电解质
D.在常温下,配制一定量的CH3COONa溶液,测其pH,若pH大于7,则可证明醋酸为弱电解质。
你认为上述方案可行的是________________________________。
2. 一定温度下,有a、盐酸;b、硫酸;c、醋酸三种酸的稀溶液。(用a、b、c、<、=、>号填写)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是_____ ____,②同体积同物质的量浓度的三种酸,中和同物质的量浓度的NaOH消耗的体积由大到小的顺序是_________ ③当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的顺序___________ ④将c(H+)相同的三种酸均稀释10倍,pH由大到小的顺序为_____________
3.某温度(t ℃)时, KW=10-13,将此温度下pH=1的硫酸溶液aL与pH=12的氢氧化钡溶液bL混合。
①若所得混合液为中性,则a:b= 。
②若所得混合液的pH=2,则a:b= 。
A、B、C、D是常见不同主族的短周期元素,它们的原子序数逐渐增大,A元素原子最外层电子数是内层电子数的2倍;其中只有C是金属元素,且C元素原子最外层电子数是D元素原子最外层电子数的一半;B元素原子的最外层电子数比D元素原子最外层电子数少一个;E与D同主族,且E元素的非金属性比D强。
(1)写出A、B、E三种元素的元素符号:
A: B: E: 。
(2)如图所示:以C和A的单质为电极材料,两池内的电解质溶液均为D的最高价氧化物对应的水化物。a中A为 极,电池总反应的离子方程式为 ;b中A上的电极反应式为 ,一段时间后b中的pH(填“变大”、“变小”、或“不变”).
(3)工业利用CO(g)+H2O(g)H2(g)+CO2(g)
反应来制备合成氨的原料气,在1000℃下,用
高压水蒸气洗涤混合气体,再经过处理后即可直接作为合成氨的原料气。高温、高压处理的理由是 。
(4)汽车内燃机工作时产生的高温会引起N2和O2的反应N2(g)+O2(g) 2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
该反应为 反应(填“放热”、“吸热”);T℃时,该反应化学平衡常数K=1,当c(N2):c(O2):c2(NO)=1:1:l,则可逆反应的反应速率(v)应满足的关系为 。
A.v(正)>v(逆) B.v(正)<v(逆)
C.v(正)=v(逆) D.无法确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com