
题目列表(包括答案和解析)
(1)写出H2在高温下还原CuO过程中可能发生反应的化学方程式。
①CuO+H2![]() Cu+H2O,②____________________________________,
Cu+H2O,②____________________________________,
③________________________________________________________________。
(2)Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu。现有浓硫酸、浓硝酸、稀硫酸和稀硝酸四种试剂。简述如何用最简便的实验方法来检验CuO经氢气还原所得到的红色产物中是否含有Cu2O。
____________________________________________________________________。
(3)若将
(4)若有a g CuO和Cu2O的混合物,加入2.0 mol·L-1 H2SO4 V mL,使混合物恰好全部反应,则V的取值范围为________________________________________________。
下图是一些重要工业生产的转化关系(反应条件略去):
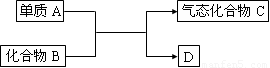
请完成下列问题:
(1)若D是单质,且与A属于同一主族,反应在高温下进行,则:
①此反应的化学方程式是 。
②D单质的一种重要用途是 。
(2)若B为黄色固体,D为固体化合物,则该反应为4FeS2+11O2  2Fe2O3+8SO2
2Fe2O3+8SO2
①当有1molC生成时,该反应转移电子的总数是 。
②将C通入足量的酸性KMnO4 溶液中,发生反应的离子方程式为 。
(3)若B是一种碱性气体,D为化合物,则:
①该反应的化学方程式是 。
②B在加热条件下与CuO反应有Cu生成,该反应的化学方程式为 ;有人提出产物Cu中可能还含有Cu2O。已知Cu+在酸性溶液中不能稳定存在,为验证Cu2O是否存在,可取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,则证明含有Cu2O。请写出发生反应的化学方程式:_________。
(08青岛质检)(8分)现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。
|
已知:①Cu+在酸性溶液中不稳定,可发生自身氧化还原反应;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液。
回答下列问题:
(1)矿石用稀硫酸处理过程中Cu2O发生反应的离子方程式为: ;
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体的化学式是 。若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层1暴露在空气中发生反应的离子方程式 。
(3)写出电解过程中阳极(惰性电极)发生反应的电极反应式: 。
(4)“循环III”中反萃取剂的主要成分是 。
现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。

已知:①Cu+在酸性溶液中不稳定,可发生自身氧化还原反应;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液。
回答下列问题:
(1)矿石用稀硫酸处理过程中Cu2O发生反应的离子方程式为: ;
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体的化学式是 。若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层1暴露在空气中发生反应的离子方程式 。
(3)写出电解过程中阳极(惰性电极)发生反应的电极反应式: 。
(4)“循环III”中反萃取剂的主要成分是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com