
题目列表(包括答案和解析)
| ||
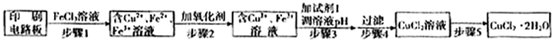
| 1 |
| 2 |
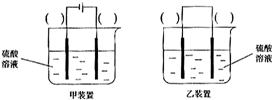
| ||
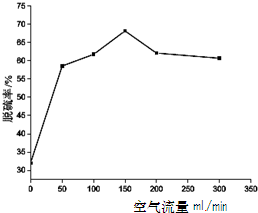
(1)写出H2在高温下还原CuO过程中可能发生反应的化学方程式。
①CuO+H2![]() Cu+H2O,②____________________________________,
Cu+H2O,②____________________________________,
③________________________________________________________________。
(2)Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu。现有浓硫酸、浓硝酸、稀硫酸和稀硝酸四种试剂。简述如何用最简便的实验方法来检验CuO经氢气还原所得到的红色产物中是否含有Cu2O。
____________________________________________________________________。
(3)若将
(4)若有a g CuO和Cu2O的混合物,加入2.0 mol·L-1 H2SO4 V mL,使混合物恰好全部反应,则V的取值范围为________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com