
题目列表(包括答案和解析)
| 剩余固体的质量 | 原始固体质量 |
类推的思维方法在化学学习与研究中常会产生错误的结论。因此,类推出的结论最终要经过实践的检验才能决定其正确与否。以下几种类推结论中,正确的是
A.Fe3O4可以写成FeO·Fe2O3,Pb3O4也可以写成PbO·Pb2O3
B.不能用电解AICl3溶液来制取金属铝,也不能用电解MgCl2溶液来制取金属镁
C.Fe和S直接化合不能得到Fe2S3,Al和S直接化合也不能得到Al2S3
D.FeS可以和稀硫酸反应制取硫化氢气体,CuS也可以和稀硫酸反应制取硫化氢气体
A.Mg失火不能用CO2灭火,Na失火也不能用CO2灭火?
B.工业上电解熔融MgCl2制取金属镁,工业上也用电解熔融AlCl3的方法制取金属铝?
C.Al与S直接化合可以得到Al2S3,Fe与S直接化合也可以得到Fe2S3?
D.Fe3O4可以写成FeO·Fe2O3,Pb3O4也可写成PbO·Pb2O3
Ⅰ)纯净的过氧化钙(CaO2)难溶于水、乙醇,常温下较为稳定。CaO2·8H2O在0℃时稳定,加热至130℃时逐渐变为无水CaO2。在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下:
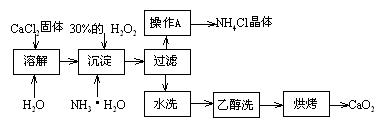
根据以上信息,回答下列问题:
⑴用上述方法制取CaO2·8H2O的化学方程式是_▲_;
⑵测定产品中CaO2的含量的实验步骤是(己知:I2+2S2O32-=2I-+S4O62-):
第一步:准确称取ag产品于锥形瓶中,加入适量蒸馏水和过量的bgKI品体,再滴入适量2mol·L-1的H2SO4溶液,充分反应:
第二步:向上述锥形瓶中加入几滴淀粉溶液:
第三步:逐滴加入浓度为cmol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。
①第三步反应完全时的现象为 ▲ ;
②产品中CaO2的质量分数为 ▲ (用字母表示);
③某同学经实验测得产品中CaO2的质量分数偏高,造成偏高的原因是(测定过程中由操作产生的误差忽略不计,用离子方程式表示) ▲ 。
Ⅱ)硫酸铜是一种重要的化工原料,工业上常用硫酸为原料来制备硫酸铜。
⑴工业上生产硫酸过程中,焙烧硫铁矿时产生的废渣是一种二次资源。
①为了从废渣中磁选获得品位合格的铁精矿,高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4。写出该反应的化学方程式_ ▲ _;实验发现:CO太多或太少都会导致磁铁矿产率降低,原因是 ▲ 。
②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物。反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液。写出氯化焙烧工艺中生成HCl的化学方程式 ▲ 。
⑵测定硫酸铜品体中结品水含量的实验步骤为:
步骤1:准确称量一个洁净、干燥的坩埚;
步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重
步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重:
步骤5: ▲ ;
步骤6:根据实验数据计算硫酸铜晶体试样中结晶水的质量分数。
请完成实验步骤5。
(3)已知硫酸铜晶体受热可以逐步失去结晶水,温度升高还可以分解生成铜的氧化物。取25.0gCuSO4·5H2O晶体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:
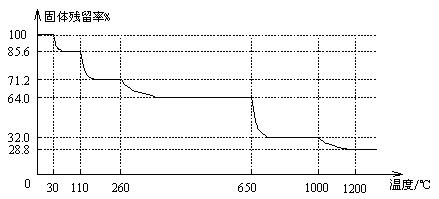
在110℃时所得固体的成分为 ▲ ;在1200℃并恒温1小时,反应所得气态产物除去水后,物质的量为 ▲ 。(填字母)
A.0mol B.0.1mol C.0.125mol D.大于0.125mol
写出Fe2O3与Al粉混合物发生铝热反应的化学方程式: 。为使该铝热反应顺利进行,还需要的辅助试剂有 。
实验探究:我们发现教材【实验4—1】的本实验,没有要求检验反应产物铁单质的存在。请你说一说本实验结束后检验蒸发皿中沙子里熔渣物里是否含有单质铁的方法 。如果没有检验出金属铁,请你说出可能的原因是什么?或提出如何改进实验的建议: 。(能回答其中一点即可)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com