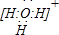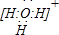Ⅰ.A、B、C分别代表三种不同的短周期元素.A原子的最外层电子排布为ns
1,B原子的价电子排布为ns
2np
2,C原子的最外层电子数是其电子层数的3倍.
(1)若A原子的最外层电子排布为1s
1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于
σ
σ
键,A与C所形成的化合物的熔沸点明显高于A与C的同主族元素所形成的化合物的熔沸点,其原因是
水分子之间存在氢键
水分子之间存在氢键
;
(2)当n=2时,B与C形成的晶体属于
分子
分子
晶体.当n=3时,B与C形成的晶体中,B原子的杂化方式为
sp3
sp3
,微粒间的作用力是
共价键
共价键
;
Ⅱ.元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.第四周期过渡元素的明显特征是形成多种多样的配合物.
(3)CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)
5]、羰基镍[Ni(CO)
4].CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为
C≡O
C≡O
,与CO互为等电子体的离子为
CN-
CN-
(填化学式).
(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.镓的基态原子的电子排布式是
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s24p1
,Ga的第一电离能却明显低于Zn,原因是
Ga失去1个电子后内层电子达到全充满的稳定状态,而Zn的4s容纳2个电子、处于全满稳定状态,能量较低,Zn第一电离能较高
Ga失去1个电子后内层电子达到全充满的稳定状态,而Zn的4s容纳2个电子、处于全满稳定状态,能量较低,Zn第一电离能较高
.
(5)用价层电子对互斥理论预测H
2Se和BBr
3的立体结构,两个结论都正确的是
d
d
.
a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形.