Ⅰ.已知:4Al(s)+3O
2(g)=2Al
2O
3(s)△H=-2834.9KJ?mol
-1Fe
2O
3(s)+
C(s)=
CO
2(g)+2Fe(s)△H=+234.1KJ?mol
-1C(s)+O
2(g)=CO
2(g)△H=-393.5KJ?mol
-1写出铝与氧化铁发生铝热反应的热化学方程式______.
Ⅱ.在2L密闭容器内,800℃时反应:2NO(g)+O
2(g)?2NO
2(g)△H<0体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=______;用O
2表示从0~2s内该反应的平均速率ν(O
2)=______.
(2)下列研究目的和示意图相符的是______.
| A | B | C | D |
| 研究目的 | 压强对反应的影响(P1>P2) | 温度对反应的影响 | 平衡体系增加O2对反应的影响 | 催化剂对反应的影响 |
| 图示 | 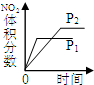 | 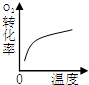 | 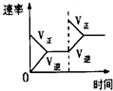 | 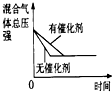 |
Ⅲ.科学家制造出一种使用固体电解质的高效燃料电池.一个电极通入空气,另一个电极通入燃料蒸汽.其中固体电解质是掺杂了Y
2O
3的ZrO
2固体,它在高温下能传导O
2-离子(其中氧化反应发生完全).以丙烷(C
3H
8)代表燃料.
(1)电池的负极反应式为______;
(2)放电时固体电解质里的O
2-离子向______极移动(填“正”或“负”).




