
题目列表(包括答案和解析)
50 mL 0.50 mol?L-1盐酸与50 mL 0.55 mol?L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
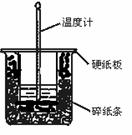
![]() (1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
![]() (2)烧杯间填满碎纸条的作用是 。
(2)烧杯间填满碎纸条的作用是 。
![]() (3)大烧杯上如不盖硬纸板,求得的中和热数值
(3)大烧杯上如不盖硬纸板,求得的中和热数值
![]() (填“偏大”“偏小”“无影响”)。
(填“偏大”“偏小”“无影响”)。
![]() (4)实验改用60 mL 0.50 mol? L-1盐酸跟50 mL 0.55 mol? L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”),简述理 由: 。
(4)实验改用60 mL 0.50 mol? L-1盐酸跟50 mL 0.55 mol? L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”),简述理 由: 。
![]() (5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50 mol?L-1NaOH溶液进行上述实验,测得的中和热的数值会 。(均填“偏大”“偏小”“无影响”)
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50 mol?L-1NaOH溶液进行上述实验,测得的中和热的数值会 。(均填“偏大”“偏小”“无影响”)
![]()
![]()
用18.4 mol?L-1 的浓H2SO4配制100 mL浓度为1 mol?L-1的稀H2SO4, 其操作可分为以下各步:
A.用量筒量取______ mL浓H2SO4,缓缓注入装有约50 mL蒸馏水的烧杯里,并用玻璃棒搅拌;
B.用约30 mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将每次洗液转移入容量瓶里;
C.将稀释后的H2SO4溶液小心地转移到容量瓶里;
D.检查____mL容量瓶口是否发生滴漏;
E.将蒸馏水直接加入容量瓶,至液面接近环形刻度线1~ 2cm处;
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G.用胶头滴管向容量瓶里逐滴滴入蒸馏水,至液面最低点恰好和环形刻度线相切.
据此填写: (1)填写以上空格.
(2)正确的操作顺序是(用字母填写) ______________________.
(3)进行A步操作时,应选择下列量器①10 mL量筒、②50 mL量筒、③100 mL量筒、④200 mL量筒中的(填序号) ___________.如果对装有浓H2SO4的量筒读数如右图所示读取,配制的稀H2SO4的浓度将(偏高、偏低、无影响) ____________.
![]()
(4)进行A步操作后,必须____________后,才能进行C步操作.
用18.4 mol?L-1 的浓H2SO4配制100 mL浓度为1 mol?L-1的稀H2SO4, 其操作可分为以下各步:
A.用量筒量取______ mL浓H2SO4,缓缓注入装有约50 mL蒸馏水的烧杯里,并用玻璃棒搅拌;
B.用约30 mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将每次洗液转移入容量瓶里;
C.将稀释后的H2SO4溶液小心地转移到容量瓶里;
D.检查____mL容量瓶口是否发生滴漏;
E.将蒸馏水直接加入容量瓶,至液面接近环形刻度线1~ 2cm处;
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G.用胶头滴管向容量瓶里逐滴滴入蒸馏水,至液面最低点恰好和环形刻度线相切.
据此填写: (1)填写以上空格.
(2)正确的操作顺序是(用字母填写) ______________________.
(3)进行A步操作时,应选择下列量器①10 mL量筒、②50 mL量筒、③100 mL量筒、④200 mL量筒中的(填序号) ___________.如果对装有浓H2SO4的量筒读数如右图所示读取,配制的稀H2SO4的浓度将(偏高、偏低、无影响) ____________.
![]()
(4)进行A步操作后,必须____________后,才能进行C步操作.
用0.1 mol?L-1 NaOH溶液滴定0.1 mol?L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH是.
A.4 B.7.2 C.10 D.11.3
用50 mL0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液,在如图所示的装置中进行中和反应。测定强酸与强碱反应的反应热。
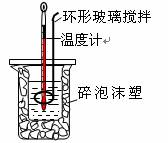
(1)在该实验中,量取50 mL 盐酸或NaOH 溶液,需要用到的玻璃仪器是___________。
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是______________________________。
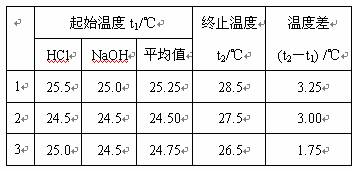
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指__________________温度。
(4)计算该实验发生中和反应时放出的热量为________________kJ(中和后生成的溶液的比热容c=4.18J/(g?℃) ,稀溶液的密度都为1g/cm3)。
(5) 如果用50 mL 0.55mol/L的氨水(NH3?H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是
________________________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com