
题目列表(包括答案和解析)
请回答有关问题:
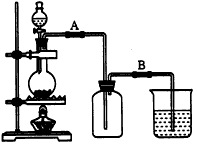
(1)如何检查用塞子(插有导管和仪器)塞紧的D的气密性?答:_ ______。
(2)若导入的CO2不干燥,会在E中发生副反应,其化学方程式为:_____ ___。若在A中盛固体CaCO3,a中盛6mol/L的盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处装置(不必画图)和其中的试剂是:________、________。
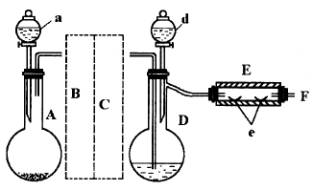
(3)实验时,装置D和E的橡胶塞最好用铅箔包住,原因是___ _____。
(4)反应过程中要不断通入CO2,其主要作用是①____ ____;②_____ ___ 。
(5)E中的反应为:2Fe+3Br![]()
![]() 2FeBr
2FeBr![]() ,2FeB
,2FeB![]()
![]() 2FeB
2FeB![]() r2+Br2
r2+Br2![]() ↑,则此实验中溴化亚铁的产率为________。
↑,则此实验中溴化亚铁的产率为________。
(6)为防止污染空气,实验时应在F处连接盛________的尾气吸收装置。
树德中学某化学兴趣小组在实验室用MnO2与浓盐酸反应制备C12(发生装置如图所示)。
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是 序号)。
A.往烧瓶中加入浓盐酸
B.加热
C.往烧瓶中加入MnO2粉末
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,兴趣小组同学提出下列实验探究方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量
乙方案:采用酸碱恰好中和(有指示剂)的方法测定
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量
丁方案:与足量Zn反应,测量生成的H2体积(换算为标准状况)
继而进行下列判断和实验:
①判定甲方案是否可行 (填“是”或“否”),理由是 。
②进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,滴入0.200 0 mol/L的NaOH溶液,消耗NaOH溶液22.00 mL,该次测得试样中盐酸浓度为 mol·L一1;
b.重复以上操作多次取平均值获得实验结果
③判断丙方案的实验结果 (填“偏大"、“偏小”或“准确”)。
(已知:部分CaCO3会转化为更难溶的MnCO3)
④进行丁方案实验:装置如图所示(夹持器具已略去)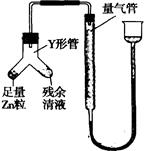
(i)使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
(ii)反应完毕,每间隔l分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素)
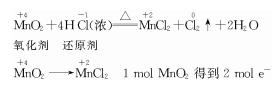
(1)写出该反应的化学方程式: 。
(2)上述反应中,还原剂是 ,若有1 mol氧化剂参加反应,转移的电子的物质的量是 mol。
(3)实验开始前,某学生对装置进行了气密性检查。方法:连接好装置后,用弹簧夹夹住 (填“A”或“B”)处橡皮管;向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静置观察,当观察到分液漏斗中 时,表明该装置不漏气。
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中错误的是(填序号) 。
A.氢氧化钠溶液 B.碳酸钠浓溶液 C.浓硫酸
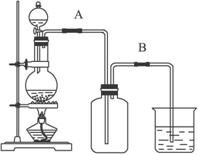
(1)写出该反应的化学方程式:____________________________________。
(2)上述反应中,还原剂是_________,若有1 mol氧化剂参加反应,转移的电子的物质的量是_________mol。
(3)实验开始前,某学生对装置进行了气密性检查。方法是:连接好装置之后,用弹簧夹夹住_________处(填“A”或“B”)橡皮管;向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静置观察。当观察到分液漏斗中_________时,表明该装置不漏气。
(4)若要收集纯净干燥的氯气,可以在收集之前让氯气先通过两洗气瓶,两洗气瓶所盛试剂依次是__________________、_________________。
(5)兴趣小组同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中错误的是__________(填写序号)。
A.氢氧化钠溶液 B.碳酸钠溶液 C.浓硫酸
1.B 2.D 3.B 4.D 5.A 6.C 7.AB 8.C 9.A 10.AD 11.CD
12.B 13.C 14.C 15.C 16.C 17.D 18.C 19.D 20.C 21.D 22.B
23.本题考查学生称量、加热、溶解、结晶等基本操作,同时要求理论联系实际确定有关化学方程式和计算溶解度.
通过计算知:用50 mL
70℃热水与24 gKCl制几乎饱和的溶液,再用25 mL 70℃热水与 配制成饱和溶液,将此两种溶液混合、搅匀、静止、冷却,将陆续析出
配制成饱和溶液,将此两种溶液混合、搅匀、静止、冷却,将陆续析出 晶体,至20℃时,减压过滤使
晶体,至20℃时,减压过滤使 分离出来.
分离出来.
24.(1)无机酸酯

(2)X可能是沸石(或碎瓷片);防止暴沸
(3)回流冷凝易挥发的反应物:a;b
(4)用足量水洗涤,分液除去乙醇,加稀NaOH溶液,分液除去碘.
25.(1)C→B→D→A→G→H→E→F
(2)使漏斗下端管口紧靠烧杯内壁;及时关闭活塞,不要让上层液体流出;使漏斗内外空气相通以保证(G)操作时漏斗里液体能够流出.
(3) 与水不互溶;而且碘在
与水不互溶;而且碘在 中的溶解度比在水中大很多.
中的溶解度比在水中大很多.
(4)A、C
提示:(4)热裂汽油中含有不饱和气态烃如丙烯、丁烯与溴发生加成反应.
26.(1)AEF (2)AB (3)AF(或AEF) (4)D (5)安全瓶防止碱液倒吸
27.(1)4 a、d、f、h h吸收 吸收
吸收 天平
天平
(2)试样质量=碳元素质量+氢元素质量为烃
试样质量>碳元素质量+氢元素质量为烃的含氧衍生物
(3)B
28.(1)
(2)碱石灰;无水 只能吸水,不能吸收
只能吸水,不能吸收 .
.
(3) (或
(或 )
)
(4) ;放热;反应开始后断开电键K,铂丝能继续保持红热.
;放热;反应开始后断开电键K,铂丝能继续保持红热.
(5)气体颜色变浅; 发生反应:
发生反应:

 ,属于放热反应,达到平衡后,若降低温度,平衡向右移动,
,属于放热反应,达到平衡后,若降低温度,平衡向右移动, 浓度减少,
浓度减少, 浓度增大,而
浓度增大,而 无色,所以气体颜色变浅.
无色,所以气体颜色变浅.
29.本题考查学生乙炔的制取方法、干燥、氧化原理及产物的吸收测定顺序.由于制得的乙炔气含水对燃烧及产物测定有影响,故制得的乙炔气体必须先干燥,然后再进行题中的催化氧化,乃至测定产物的质量.所以(1)G、E、F、H、I、C、D、A
(2)吸收燃烧产生的 气体;吸收产生的水蒸气;吸收乙炔中的水蒸气.
气体;吸收产生的水蒸气;吸收乙炔中的水蒸气.
(3)

(4)
30.解析:过程如下:


答案:①将废水过滤,目的是除去其中的悬浮泥沙等不溶物;
②往①的滤液中加入足量锌粉,将其中的 置换出来;
置换出来;
③过滤②中的不溶物,滤出Ag和过量的锌粉;
④往③的滤渣中加入过量的稀硫酸,使其中的锌粉转化为 而进入溶液;
而进入溶液;
⑤过滤,将④中没溶解的Ag滤出回收;
⑥将③、⑤得到的滤液合并,蒸发浓缩,使 析出后回收.
析出后回收.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com