
题目列表(包括答案和解析)
| O | 2- 3 |
| O | 2- 6 |
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(18分)以工业碳酸钙(含少量Na+、A13+、Fe3+等杂质)生产医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3—99.3%)的工艺流程为(可能用到的原子量Cl 35.5 Ca 40 O 16)
(1)CaCO3与盐酸反应的离子方程式 。
(2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为 。
②过滤时需用的玻璃仪器除烧杯、玻璃棒外还有 。
(3)酸化时加盐酸将溶液的PH调节到4.0左右,其目的为:
① ,②防止Ca2+在蒸发时发生水解。
(4)操作Ⅰ中应包括 、 、过滤等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。
①通过计算,样品含CaCl2·2H2O的质量百分数为 .(只写计算式不计算结果)。
②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因之一为 。
(18分)以工业碳酸钙(含少量Na+、A13+、Fe3+等杂质)生产医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3—99.3%)的工艺流程为(可能用到的原子量Cl 35.5 Ca 40 O 16)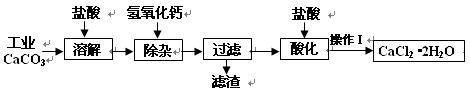
(1)CaCO3与盐酸反应的离子方程式 。
(2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为 。
②过滤时需用的玻璃仪器除烧杯、玻璃棒外还有 。
(3)酸化时加盐酸将溶液的PH调节到4.0左右,其目的为:
① ,②防止Ca2+在蒸发时发生水解。
(4)操作Ⅰ中应包括 、 、过滤等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。
①通过计算,样品含CaCl2·2H2O的质量百分数为 .(只写计算式不计算结果)。
②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因之一为 。
(18分)以工业碳酸钙(含少量Na+、A13+、Fe3+等杂质)生产医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3—99.3%)的工艺流程为(可能用到的原子量Cl 35.5 Ca 40 O 16)
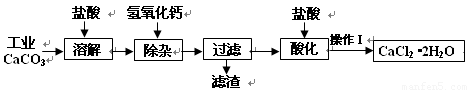
(1)CaCO3与盐酸反应的离子方程式 。
(2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为 。
②过滤时需用的玻璃仪器除烧杯、玻璃棒外还有 。
(3)酸化时加盐酸将溶液的PH调节到4.0左右,其目的为:
① ,②防止Ca2+在蒸发时发生水解。
(4)操作Ⅰ中应包括 、 、过滤等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。
①通过计算,样品含CaCl2·2H2O的质量百分数为 .(只写计算式不计算结果)。
②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因之一为 。
1.B 2.D 3.B 4.D 5.A 6.C 7.AB 8.C 9.A 10.AD 11.CD
12.B 13.C 14.C 15.C 16.C 17.D 18.C 19.D 20.C 21.D 22.B
23.本题考查学生称量、加热、溶解、结晶等基本操作,同时要求理论联系实际确定有关化学方程式和计算溶解度.
通过计算知:用50 mL
70℃热水与24 gKCl制几乎饱和的溶液,再用25 mL 70℃热水与 配制成饱和溶液,将此两种溶液混合、搅匀、静止、冷却,将陆续析出
配制成饱和溶液,将此两种溶液混合、搅匀、静止、冷却,将陆续析出 晶体,至20℃时,减压过滤使
晶体,至20℃时,减压过滤使 分离出来.
分离出来.
24.(1)无机酸酯

(2)X可能是沸石(或碎瓷片);防止暴沸
(3)回流冷凝易挥发的反应物:a;b
(4)用足量水洗涤,分液除去乙醇,加稀NaOH溶液,分液除去碘.
25.(1)C→B→D→A→G→H→E→F
(2)使漏斗下端管口紧靠烧杯内壁;及时关闭活塞,不要让上层液体流出;使漏斗内外空气相通以保证(G)操作时漏斗里液体能够流出.
(3) 与水不互溶;而且碘在
与水不互溶;而且碘在 中的溶解度比在水中大很多.
中的溶解度比在水中大很多.
(4)A、C
提示:(4)热裂汽油中含有不饱和气态烃如丙烯、丁烯与溴发生加成反应.
26.(1)AEF (2)AB (3)AF(或AEF) (4)D (5)安全瓶防止碱液倒吸
27.(1)4 a、d、f、h h吸收 吸收
吸收 天平
天平
(2)试样质量=碳元素质量+氢元素质量为烃
试样质量>碳元素质量+氢元素质量为烃的含氧衍生物
(3)B
28.(1)
(2)碱石灰;无水 只能吸水,不能吸收
只能吸水,不能吸收 .
.
(3) (或
(或 )
)
(4) ;放热;反应开始后断开电键K,铂丝能继续保持红热.
;放热;反应开始后断开电键K,铂丝能继续保持红热.
(5)气体颜色变浅; 发生反应:
发生反应:

 ,属于放热反应,达到平衡后,若降低温度,平衡向右移动,
,属于放热反应,达到平衡后,若降低温度,平衡向右移动, 浓度减少,
浓度减少, 浓度增大,而
浓度增大,而 无色,所以气体颜色变浅.
无色,所以气体颜色变浅.
29.本题考查学生乙炔的制取方法、干燥、氧化原理及产物的吸收测定顺序.由于制得的乙炔气含水对燃烧及产物测定有影响,故制得的乙炔气体必须先干燥,然后再进行题中的催化氧化,乃至测定产物的质量.所以(1)G、E、F、H、I、C、D、A
(2)吸收燃烧产生的 气体;吸收产生的水蒸气;吸收乙炔中的水蒸气.
气体;吸收产生的水蒸气;吸收乙炔中的水蒸气.
(3)

(4)
30.解析:过程如下:


答案:①将废水过滤,目的是除去其中的悬浮泥沙等不溶物;
②往①的滤液中加入足量锌粉,将其中的 置换出来;
置换出来;
③过滤②中的不溶物,滤出Ag和过量的锌粉;
④往③的滤渣中加入过量的稀硫酸,使其中的锌粉转化为 而进入溶液;
而进入溶液;
⑤过滤,将④中没溶解的Ag滤出回收;
⑥将③、⑤得到的滤液合并,蒸发浓缩,使 析出后回收.
析出后回收.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com