
题目列表(包括答案和解析)
| |||||||||||||||||||||||
| |||||||||||||||||||||||
已知在pH=4~5的环境中,Cu2+几乎不水解,而Fe3+几乎完全水解.某同学欲电解CuSO4溶液,并根据电极上析出铜的质量以及电极上产生气体的体积来测定铜的相对原子质量,其实验流程如图所示:

试回答下列问题:
(1)步骤①中所加入的A的化学式为________;加入A的作用是________.
(2)步骤②中所用的部分仪器如下图所示,则A接直流电源的________极.
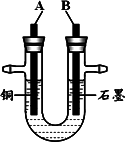
(3)电解开始后的一段时间内,在U管内可观察到的现象是________.
其电解反应的离子方程式为________.
(4)下列实验操作属必要的是________(填字母).
A、称量电解前电极的质量
B、电解后的电极在烘干称重前,必须用蒸馏水冲洗
C、刮下电解后电极上的铜,并清洗、称量
D、电极烘干称重的操作必须按烘干→称量→再烘干→再称重进行两次
E、在有空气存在的情况下,电极烘干必须采用低温烘干法
(5)铜的相对原子质量为________(用含n、V的表达式表示).
通常状况下,过氧化氢是一种无色透明的液体,在实验室和生产中应用广泛.
(1)火箭推进器中分别装有联氨(N2H4)和过氧化氢,它们发生反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-642.2 kJ·mol-1
又知:2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.4 kJ·mol-1
H2O(l)=H2O(g) △H=44 kJ·mol-1
请写出N2H4(l)与O2(g)反应生成N2(g)和H2O(l)的热化学方程式:________.
(2)H2O2是一种二元弱酸,其第一步电离的电离方程式为________.
(3)过二硫酸铵法是目前最流行的制备H2O2的方法.即电解含H2SO4的(NH4)2SO4溶液制取(NH4)2S2O8,如下图所示,再加热水解即可得H2O2和(NH4)2SO4.

①电解时,阳极的电极方程式________;
②写出生成H2O2的反应的化学方程式:
________.
(4)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能降解有机污染物p-CP.控制p-CP的初始浓度相同,在不同实验条件下进行如下实验,测得p-CP的浓度随时间变化关系如下图所示.
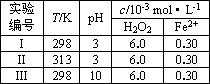
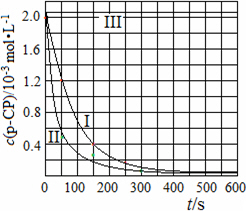
①请根据实验I的曲线,计算降解反应在50~150 s内的反应速率ν(p-CP)=________mol·L-1·s-1.
②实验I、II表明,温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请分析原因:________.
③实验III得出的结论是:pH=10时,________.
| 物质(25℃) | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 完全沉淀时的pH | ≥6.4 | ≥9.6 | 3~4 |
1.B 2.D 3.B 4.D 5.A 6.C 7.AB 8.C 9.A 10.AD 11.CD
12.B 13.C 14.C 15.C 16.C 17.D 18.C 19.D 20.C 21.D 22.B
23.本题考查学生称量、加热、溶解、结晶等基本操作,同时要求理论联系实际确定有关化学方程式和计算溶解度.
通过计算知:用50 mL
70℃热水与24 gKCl制几乎饱和的溶液,再用25 mL 70℃热水与 配制成饱和溶液,将此两种溶液混合、搅匀、静止、冷却,将陆续析出
配制成饱和溶液,将此两种溶液混合、搅匀、静止、冷却,将陆续析出 晶体,至20℃时,减压过滤使
晶体,至20℃时,减压过滤使 分离出来.
分离出来.
24.(1)无机酸酯

(2)X可能是沸石(或碎瓷片);防止暴沸
(3)回流冷凝易挥发的反应物:a;b
(4)用足量水洗涤,分液除去乙醇,加稀NaOH溶液,分液除去碘.
25.(1)C→B→D→A→G→H→E→F
(2)使漏斗下端管口紧靠烧杯内壁;及时关闭活塞,不要让上层液体流出;使漏斗内外空气相通以保证(G)操作时漏斗里液体能够流出.
(3) 与水不互溶;而且碘在
与水不互溶;而且碘在 中的溶解度比在水中大很多.
中的溶解度比在水中大很多.
(4)A、C
提示:(4)热裂汽油中含有不饱和气态烃如丙烯、丁烯与溴发生加成反应.
26.(1)AEF (2)AB (3)AF(或AEF) (4)D (5)安全瓶防止碱液倒吸
27.(1)4 a、d、f、h h吸收 吸收
吸收 天平
天平
(2)试样质量=碳元素质量+氢元素质量为烃
试样质量>碳元素质量+氢元素质量为烃的含氧衍生物
(3)B
28.(1)
(2)碱石灰;无水 只能吸水,不能吸收
只能吸水,不能吸收 .
.
(3) (或
(或 )
)
(4) ;放热;反应开始后断开电键K,铂丝能继续保持红热.
;放热;反应开始后断开电键K,铂丝能继续保持红热.
(5)气体颜色变浅; 发生反应:
发生反应:

 ,属于放热反应,达到平衡后,若降低温度,平衡向右移动,
,属于放热反应,达到平衡后,若降低温度,平衡向右移动, 浓度减少,
浓度减少, 浓度增大,而
浓度增大,而 无色,所以气体颜色变浅.
无色,所以气体颜色变浅.
29.本题考查学生乙炔的制取方法、干燥、氧化原理及产物的吸收测定顺序.由于制得的乙炔气含水对燃烧及产物测定有影响,故制得的乙炔气体必须先干燥,然后再进行题中的催化氧化,乃至测定产物的质量.所以(1)G、E、F、H、I、C、D、A
(2)吸收燃烧产生的 气体;吸收产生的水蒸气;吸收乙炔中的水蒸气.
气体;吸收产生的水蒸气;吸收乙炔中的水蒸气.
(3)

(4)
30.解析:过程如下:


答案:①将废水过滤,目的是除去其中的悬浮泥沙等不溶物;
②往①的滤液中加入足量锌粉,将其中的 置换出来;
置换出来;
③过滤②中的不溶物,滤出Ag和过量的锌粉;
④往③的滤渣中加入过量的稀硫酸,使其中的锌粉转化为 而进入溶液;
而进入溶液;
⑤过滤,将④中没溶解的Ag滤出回收;
⑥将③、⑤得到的滤液合并,蒸发浓缩,使 析出后回收.
析出后回收.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com