
题目列表(包括答案和解析)
元素周期表是指导化学学习的重要工具。下图为元素周期表的一部分。请按要求填空。
|
|
|||||
|
|
|
|
N |
|
F |
|
|
Mg |
Al |
|
|
S |
Cl |
|
(1)N在元素周期表中的位置是_____;N和F处于同一行,是由于它们的_________相同。
(2)以上元素中,原子半径最小的是_____(写元素符号);最高价氧化物对应水化物中酸性最强的是__________(写化学式)。
(3)Mg和Al中,金属性较强的是_______(写元素符号),写出一条能说明该结论的事实____________________。
(4)S和Cl中,非金属性较强的是_____(写元素符号),不能说明该结论的事实是_____。
a.氯气与铁反应生成FeCl3,硫与铁反应生成FeS
b.把Cl2通入H2S溶液中能发生置换反应
c.受热时H2S易分解,HCl不易分解
d.单质硫是固体,氯的单质是气体
元素周期表是指导化学学习的重要工具。下图为元素周期表的一部分。请按要求填空。
| | | |||||
| | | | N | | F | |
| Mg | Al | | | S | Cl | |

| | | |||||
| | | | N | | F | |
| Mg | Al | | | S | Cl | |
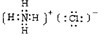
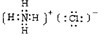
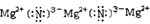
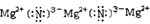
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
1.C 2.B 3.A 4.D 5.B 6.B 7.B 8.D 9.B 10.AD 11.B 12.AC 13.B 14.BD
|