
题目列表(包括答案和解析)
(本题8分)X、Y、Z、W是原子序数依次增大的同一短周期的元素,它们形成的单质中有2种为金属,1种为气体;Z元素的次外层电子数与其它各层的电子数之和相等。X、Y、W所形成的单质与其他物质之间的反应关系如下图:
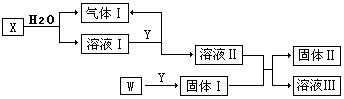
请回答下列问题:
(1)X、Y、Z、W原子对应的离子半径由小到大的顺序是 (填离子符号)。
(2)用电子式表示X、Z所形成的化合物的形成过程 。
(3)写出上述转化关系中生成溶液Ⅱ的反应的离子方程式: 。
(4)检验溶液Ⅲ中金属阳离子的方法为 。
(本题共8分)现有部分元素的性质与原子(或分子)结构如下表:
|
元素编号 |
元素性质与原子(或分子)结构 |
|
T |
最外层电子数是次外层电子数的3倍 |
|
X |
常温下单质为双原子分子,分子中含有3对共用电子对 |
|
Y |
M层比K层少1个电子 |
|
Z |
第三周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图 。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式:_____ _________。
(4)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式: 。

(本题共8分)现有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的简单离子中半径最小 |
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的简单离子中半径最小 |
一、选择题(每小题2分,计24分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
B
D
B
C
A
A
B
C
A
B
C
B
二、选择题(每小题3分,计36分)
题号
13
14
15
16
17
18
19
20
21
22
23
24
答案
BD
A
AC
BD
D
D
AD
CD
A
D
B
AD
三、填空题
25.(本题共3分)
2H2O(l)=2H2(g)+O2(g);△H=+571.6kL/mol
26.(本题共8分)
⑴Au2O3+4Na2S2O3+2H2O=2Na2S4O6+Au2O+4NaOH
|