
题目列表(包括答案和解析)
 NaH2PO4 (aq) + HCl( g)
NaH2PO4 (aq) + HCl( g) NaCl(s)+ K(g)
NaCl(s)+ K(g)(10分)用0.200 mol/L NaOH溶液滴定一份含有H3PO4与NaH2PO4的混合酸溶液,当加入5.0mL NaOH时测得溶液pH为2.16,而当滴加至15.00mL NaOH时测得溶液pH为4.68。试求:
1.原混合溶液中,H3PO4与NaH2PO4的含量各多少mmol?
2.为达到第二计量点,所需NaOH总体积多少mL ?
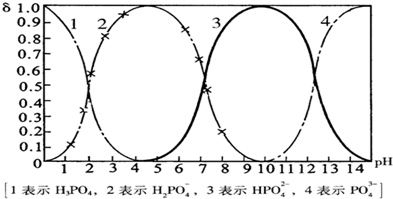
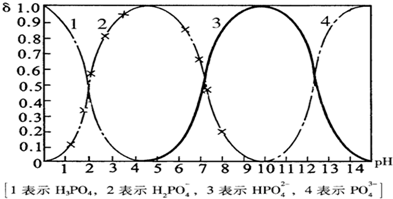
已知:H3PO4的Ka1=6.9×10-3 Ka2=6.3×10-8,Ka3=4.8×10-13。
A.实验室制取HF所用仪器和酸与制取氯化氢完全相同
B.实验室可用加热NaCl和NaHSO4混合固体的方法制备HCl气体
C.实验室用NaBr与浓H2SO4混合加热制取HBr
D.用浓H3PO4与NaI反应制取HI气体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com