
题目列表(包括答案和解析)
| |||||||||||||||||||||||
| 容器 | A | B |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| CH3OH(g)浓度(mol?L-1) | c1 | c2 |
| 反应能量变化 | 放出29.4kJ | 吸收akJ |
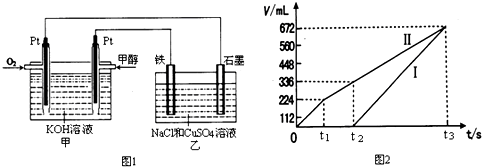
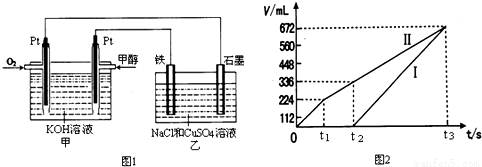
| 容器 | A | B |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| CH3OH(g)浓度 | c1 | c2 |
| 反应能量变化 | 放出29.4kJ | 吸收akJ |
氨有着广泛的用途,如可用于化肥、硝酸、合成纤维等工业生产。氨的水溶液中存在电离平衡,常用电离常数Kb和电离度α来定量表示其电离程度。Kb和α常用的测定方法:在一定温度时用酸度计测定一系列已知浓度氨水的pH,可得各浓度氨水对应的c(OH-),然后通过换算求得各对应的α值和Kb值。下面是某中学化学兴趣小组在25℃时测定一系列浓度氨水的pH所对应的c(OH-):
【仪器与试剂】酸度计、50 mL碱式滴定管、100mL烧杯、 0.10 mol·L-1 氨水
【实验数据】(不必填表格)
| 烧杯号 | V氨水 (mL) | V水(mL) | c (NH3·H2O) (mol·L-1) | c(OH-) | Kb | α |
| 1 | 50.00 | 0.00 |
| 1.34×10-3 |
|
|
| 2 | 25.00 | 25.00 |
| 9.48×10-4 |
|
|
| 3 | 5.00 | 45.00 |
| 4.24×10-4 |
|
|
请根据以上信息回答下述问题:
(1)25℃时,氨水的电离常数:Kb![]() ▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。
▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。
(2)用0.10mol·L—1盐酸分别滴定20.00mL0.10mol·L—1的NaOH溶液和20.00mL0.10mol·L—1
氨水所得的滴定曲线如下:
请指出盐酸滴定氨水的曲线为 ▲ (填A或B),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序 ▲ 。
(3)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧试验机中相关的反应有:
4NH3(g)+3O2(g)= 2N2(g)+6H2O(l) △H1 ①
4NH3(g)+5O2(g)= 4NO(g)+6H2O(l) △H2 ②
4NH3(g)+6NO(g)= 5N2(g)+6H2O(l) △H3 ③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= ▲ 。
(4)Allis-Chalmers制造公司发现可以用氨作为燃料电池的燃料。其总反应式为4NH3+3O2=2N2+6H2O,正极上的电极反应式为O2+2H2O+4e—=4OH—,则负极上的电极反应式为 ▲ 。
氨有着广泛的用途,如可用于化肥、硝酸、合成纤维等工业生产。氨的水溶液中存在电离平衡,常用电离常数Kb和电离度α来定量表示其电离程度。Kb和α常用的测定方法:在一定温度时用酸度计测定一系列已知浓度氨水的pH,可得各浓度氨水对应的c(OH-),然后通过换算求得各对应的α值和Kb值。下面是某中学化学兴趣小组在25℃时测定一系列浓度氨水的pH所对应的c(OH-):
【仪器与试剂】酸度计、50 mL碱式滴定管、100mL烧杯、 0.10 mol·L-1氨水
【实验数据】(不必填表格)
| 烧杯号 | V氨水 (mL) | V水(mL) | c (NH3·H2O)(mol·L-1) | c(OH-) | Kb | α |
| 1 | 50.00 | 0.00 | | 1.34×10-3 | | |
| 2 | 25.00 | 25.00 | | 9.48×10-4 | | |
| 3 | 5.00 | 45.00 | | 4.24×10-4 | | |
 ▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。
▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。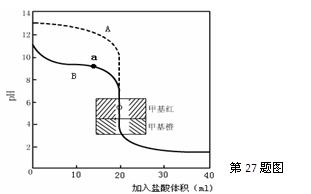
一、二选择题(每小题3分,共45分)
1-5.DCAAC 6-10.ACDCC 11.CD 12.C 13.AD 14.AC 15.C
第Ⅱ卷(非选择题,共55分)
|