
题目列表(包括答案和解析)
(12分)回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图。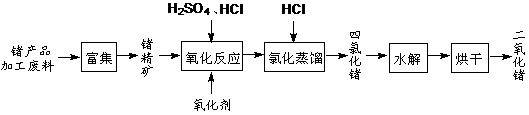
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式:
▲ 。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是:
▲ 。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为: ▲ 。温度对GeCl4的水解率产生的影响如右图所示。为控制最佳的反应温度,实验时可采取的措施为 ▲ 。(填字母)
A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)根据下表1 中不同pH下二氧化锗的溶解率,结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因 ▲ ,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应 ▲ 。
表1 不同pH下二氧化锗的溶解率
| pH | 4 | 5 | 6 | 7 | 8 | 9 |
| 溶解率/% | 47.60 | 32.53 | 11.19 | 5.27 | 1.96 | 8.85 |


| ||
| ||

 如图1所示,其原因是
如图1所示,其原因是
| 元素 性质 |
A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
1
2
3
4
5
6
7
8
A
B
C
D
B
C
D
A
9
10
11
12
13
14
15
16
D
A
C
C
A
D
B
B
17.(1)促进, B (2)甲大 (各1分)
乙用氯化铵溶液稀释后,.files/image325.gif) 增大很多,使
增大很多,使.files/image212.gif) 的电离平衡向抑制电离的方向移动;
的电离平衡向抑制电离的方向移动;.files/image328.gif) 发生水解,使稀释后的乙溶液的
发生水解,使稀释后的乙溶液的.files/image330.gif) )增大 (答
)增大 (答.files/image328.gif) 水解使溶液
水解使溶液.files/image153.gif) 减小不给分) (2分)
减小不给分) (2分)
(3)③ 适量的.files/image036.gif) (各1分)
(各1分)
18.(1).files/image335.gif) ,
,.files/image337.gif) ;(各2分)
;(各2分)
(2)①.files/image261.gif) (1分) ②
(1分) ②.files/image340.gif) (1分)
(1分)
得.files/image342.gif)
.files/image343.gif) |
.files/image344.gif)
.files/image345.gif) ③
③.files/image347.gif) (2分)
(2分)
得.files/image349.gif)
④ 1:2 (2分)
19.(1) .files/image351.gif) (各2分)
(各2分)
(2) .files/image353.gif)
(3)0.5 1 (4) D
20.(1)第三周期.files/image355.gif) 族(2分)
族(2分)
(2) .files/image030.gif) 属于分子晶体而
属于分子晶体而.files/image358.gif) 属于原子晶体(2分)
属于原子晶体(2分)
(3) .files/image360.gif) (2分)
(2分)
(4).files/image362.gif) 、
、.files/image364.gif) 、
、.files/image366.gif) 、
、.files/image368.gif) (写出3种即可)(3分)
(写出3种即可)(3分)
21.(1) ③⑤⑦ (2) C (各2分)
22.(1).files/image076.gif) 、
、.files/image030.gif) 等(2分)
等(2分)
(2).files/image372.gif) ;
;.files/image374.gif) ;
;.files/image012.gif) (各1分)
(各1分)
(3)① .files/image377.gif) (1分)
(1分)
②a、b (各1分) .files/image379.gif) (1分) 双手紧握 (或微热) 试管丁使试管中气体逸出,
(1分) 双手紧握 (或微热) 试管丁使试管中气体逸出,.files/image034.gif) 与水接触后即可引发烧杯中的水倒流入试管丁(2分)
与水接触后即可引发烧杯中的水倒流入试管丁(2分)
③
.files/image382.gif) (2分)
(2分)
23.(1).files/image186.gif) (2)
(2).files/image385.gif) (3)
(3).files/image387.gif) (4)
(4) .files/image389.gif) (各2分)
(各2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com