
题目列表(包括答案和解析)
| 实验 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L(标准状况) |
| 1 | 7.24 | 50.00 | 1.792 |
| 2 | 14.48 | 50.00 | 3.584 |
| 3 | 21.72 | 50.00 | 4.032 |
| 4 | 36.20 | 50.00 | 2.240 |
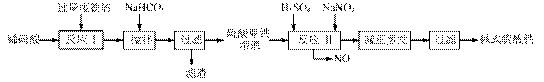
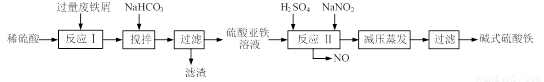
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
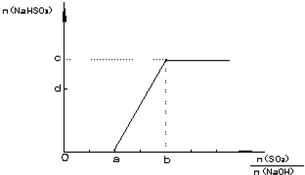
(1)加入少量NaHCO3的目的是调节pH,使溶液中的 沉淀,该工艺中“搅拌”的作用是 。
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(12分)碱式硫酸铁[Fe(OH) SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下: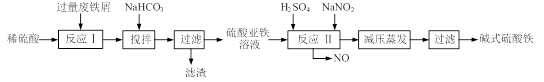
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(12分)碱式硫酸铁[Fe(OH) SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
3.4 |
|
完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH,使溶液中的 沉淀,该工艺中“搅拌”的作用是 。
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |

答案
C
C
D
BD
BC
AC
BC
22题
Ⅰ.① 2.06 (2分 ) ②  (2分)
(2分)
③( C ) 2分
Ⅱ.①瞬时速度等于极短时间或极短位移内的平均速度.(只要意思表示对就给分)2分
②
③ 在误差允许的范围内,重力势能的减少量等于动能的增加量(说出机械能是守恒的也对)(2分)
④ ( C ) 2分
23.
(1)万有引力提供向心力
 (3分)
(3分)
求出  (2分)
(2分)
(2)月球表面万有引力等于重力  (3分)
(3分)
求出  (2分)
(2分)
(3)根据

 (2分)
(2分)
求出  (2分)
(2分)
24. (1)正确。(3分)
ab杆在正中间时,外电阻最大,Rm=0.15 ,r=0.1
,r=0.1 ,(2分)
,(2分)
 (2分)
(2分)
∴ (2分)
(2分)
(2)错误。(3分)
线框MNPQ的电功率P就是电源输出功率,当R=r时,P最大,而ab杆在正中间位置的两侧某处,均有R=r。( 3分)
所以,线框MNPQ的电功率P先变大、后变小、再变大、再变小。(3分)
25.解:(1)由于线框匀速出磁场,则
对m2有: (2分)
(2分)
得T=10N (2分)
对m1有: (2分)
(2分)
又因为
联立可得: (2分)
(2分)
所以绳中拉力的功率P=Tv=20W (2分)
(2)从线框刚刚全部进入磁场到线框ad边刚要离开磁场,由动能定理得
 (4分)
(4分)
且
解得v0= =1.9m/s (3分)
=1.9m/s (3分)
(3)从初状态到线框刚刚完全出磁场,由能的转化与守恒定律可得
 (4分)
(4分)
将数值代入,整理可得线框在整个运动过程中产生的焦耳热为:
Q = 1.5 J (3分)
26.(14分)(1)Cu2O + Fe2(SO4)3+H2SO4===2CuSO4+2FeSO4 + H2O (2分) 1:1 (2分)
(2)碱(2分) KMnO4能腐蚀橡胶(2分) (3) % (2分)
% (2分)
(4)不一定准确(2分) 若矿石中有其它能将Fe 还原的杂质或含有能被KMnO4氧化的杂质,结果都会偏高,若Fe
还原的杂质或含有能被KMnO4氧化的杂质,结果都会偏高,若Fe 被空气中的氧气氧化,结果会偏低
(2分)
被空气中的氧气氧化,结果会偏低
(2分)
 27.(16分) (1) ① 2NaCl 2Na+Cl2↑
27.(16分) (1) ① 2NaCl 2Na+Cl2↑
② 阳 ; 2H++2e- = H2↑ 。 ③ NaClO 。
④ NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl 。
(2) ① 结晶 ; 防止MgCl2晶体受热水解生成Mg(OH) 2等 。
② Br2 。( 每空2分)
28.(共14分)⑴
 ⑵
⑶加成反应;缩聚反应
⑵
⑶加成反应;缩聚反应
⑷

⑸ ⑹9(各2分)
⑹9(各2分)
29.(14分)(1)引流作用(2分) (2) 2H2O2 == 2H2O + O2↑(2分) (3) 炭(或碳、或C) (2分)
(4)(一)[判断猜想]:猜想I不成立 (2分)
(二)[验证(操作)过程]:取少量滤液逐滴滴入稀氨水 (2分)
[实验现象]:先有白色沉淀、滴入过量稀氨水后白色沉淀溶解(2分);
[判断猜想]:结论:主要为氯化锌,其中含少量的氯化铵(2分)。
[若说成氯化铵和氯化锌的混合物给1分;若说成只有氯化锌没有氯化铵0分]
30.(28分)
I.(14分)
(1)A (2分); 乙 (2分); (2)左 (2分)。 b+a (2分)
(3)光照强度 (2分); CO2浓度 (2分); (4)否 (2分)
II(每空2分共14分)
(l)突触
(2)③有机磷农药 等量的生理盐水
④同时给两个神经―肌肉标本施加适当的电刺激
实验现象:震颤不止 正常收缩并及时舒张
实验结论:有机磷农药中毒能使肌肉震颤不止
31、(共16分)
(1)遗传系谱图
 I
I
II
III
标明代别(I、II、III)……(1分)
成员完整……………………(1分)
患病者图谱正确……………(2分)
(2)X(2分) 隐(2分)
由正常夫妇生下有病孩子可知该病为隐性遗传病(1分)。
又外祖母患病,两个舅舅都患病(1分),且整个家庭男性患者明显多于女性患者(1分),
因此该病最可能为X染色体上的隐性遗传病。
(2)不会患病(1分)
| ||||||||||||||