
题目列表(包括答案和解析)
(12分)晶体的最小重复单位是晶胞,晶胞一般为平行六面体。NaCl属立方面心晶格,在NaCl晶胞中8个顶点各有一个Na+,6个面心处各有一个Na+,故我们说Na+形成立方面心晶格,而在该晶胞的12条棱的中点处各有一个Cl-,在该立方晶胞的体心处还有一个Cl-,故Cl-也形成立方面心晶格。
1.KCl和NaCl的晶格型式相同。已知Na+离子的半径是Cl-离子的0.5倍,而又是K+离子的0.7倍,计算:KCl晶胞和NaCl晶胞的边长之比;KCl和NaCl晶体的密度之比。
2.将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成C原子,再在每两个不共面的“小立方体”中心处各放置一个C原子便构成了金刚石的一个晶胞,则一个金刚石的晶胞中有_______个C原子。并计算金刚石的密度。(已知C原子的半径为7.7×10-11m)
3.白硅石SiO2属AB2型共价键晶体。若将金刚石晶胞中的所有C原子换成Si原子,同时在每两个相邻的Si原子(距离最近的两个Si原子)中心联线的中点处增添一个O原子,则构成SiO2晶胞,故SiO2晶胞中有____个Si原子,____个O原子,离O原子最近的Si原子有____个,离Si原子最近的O原子有____个。
4.干冰(固态CO2)属于分子晶体。若把每个CO2分子抽象为一个质点(微粒),则其晶胞也属于立方面心晶格,故一个干冰晶胞中有_____个CO2,与1个CO2分子最近的CO2分子有_____个;在干冰分子中,原子之间靠______结合,CO2分子之间靠______结合。
如图,直线交点处的圆圈为NaCl晶体中![]() 离子或
离子或![]() 离子所处的位置.这两种离子在空间3个互相垂直的方向上都是等距离排列的.
离子所处的位置.这两种离子在空间3个互相垂直的方向上都是等距离排列的.
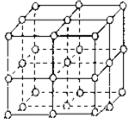
(1)请将其中代表![]() 离子的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图.
离子的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图.
(2)晶体中,在每个![]() 离子的周围与它最接近的且距离相等的
离子的周围与它最接近的且距离相等的![]() 共有_________个.
共有_________个.
(3)晶体中每一个重复的结构单元叫晶胞.在NaCl晶胞中正六面体的顶点上、面上、棱上的![]() 或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-离子的个数等于_____________,即(填计算式)___________;
或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-离子的个数等于_____________,即(填计算式)___________;![]() 离子的个数等于___________,即(填计算式)___________.
离子的个数等于___________,即(填计算式)___________.
(4)设NaCl的摩尔质量为![]() ,食盐晶体的密度为
,食盐晶体的密度为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]() .食盐晶体中两个距离最近的钠离子中心间的距离为___________cm.
.食盐晶体中两个距离最近的钠离子中心间的距离为___________cm.

图3-15
(1)请将其中代表Na+的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图。
(2)晶体中,在每个Na+的周围与它最接近的且距离相等的Na+共有_____________个。
(3)晶体中每一个重复的结构单元叫晶胞。在NaCl晶胞中正六面体的顶点上,面上,棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于_____________,即_____________(填计算式);Na+的个数等于_____________,即_____________(填计算式)。
(4)设NaCl的摩尔质量为Mr g·mol-1,食盐晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA。食盐晶体中两个距离最近的钠离子中心间的距离为_____________cm。
(17分)氮化硅是一种新型陶瓷材料,它可由石英晶体与焦炭颗粒在高温的氮气流中,通过如下反应制得:3SiO2 + 6C + 2N2 Si3N4 + 6CO,该反应过程中的能量变化如图⑵所示;回答下列问题:
Si3N4 + 6CO,该反应过程中的能量变化如图⑵所示;回答下列问题: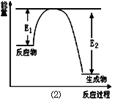
(1)上述反应中的还原剂是 ,还原产物是 。
(2)该反应是 (填“吸热”或“放热”)反应。
(3)在一定温度下,上述反应在4L密闭容器内进行,用M、N两种物质描述其物质的量随时间变化的曲线如图⑶所示: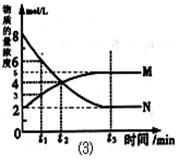
①M、N表示的物质分别为 、 。
②比较t2时刻,正逆反应速率大小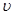 (正)
(正) 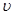 (逆)。
(逆)。
(填“>”、“=”、“<”)。.
③若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为 。
④t3时刻化学反应达到平衡时反应物的转化率为 。
(4)①某种氢燃料电池是用固体金属氧化物陶瓷作电解质,某电极上发生的电极反应为:A极H2-2e-+O2-===H2O;则A极是电池的 极 (填“正”或“负”)。
②上述合成氮化硅的反应产生的尾气不能排放,经过处理以后可以用下图所示的仪器测量尾气中CO的含量。多孔电极中间的固体氧化锆—氧化钇为电解质,这种固体电解质允许O2-在其间通过,其工作原理如图⑷所示,其中多孔Pt电极a、b分别是气体CO、O2的载体。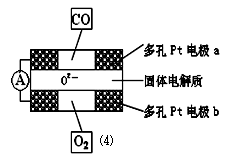
Ⅰ.该电池的正极为 (填a或b);O2 流向 (填 “正极”或“负极”)
Ⅱ.该电池的正极反应式为 ,负极反应式为 。
(14分)以明矾石[主要成分为K2SO4·Al2(SO4)3·2A12O3·6H2O]为原料生产硫酸铝晶体[Al2(SO4)3·18H2O]和明矾[KAl(SO4)2·12H2O]的实验流程如下: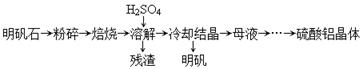
两种不同形态的氧化铝的部分性质如下表:
| 物质 | α-Al2O3 | γ-A12O3 |
| 性质 | 不溶于水和酸 | 不溶于水,溶于强酸或强碱,加热至1200℃可转化为α- Al2O3 |
| 温度/℃ 溶解度/g | 0 | 20 | 40 | 60 | 80 | 100 |
| Al2(SO4)3 | 31.2 | 36.4 | 46.1 | 59.2 | 73.0 | 89.0 |
| 明矾 | 3.0 | 5.9 | 11.7 | 25 | 71 | 154 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com