
题目列表(包括答案和解析)
Ⅰ。(每空1分,共4分)⑴通常状况下,甲同学取1 mol H2O加热到100℃时,液态水会汽化为水蒸气(如图所示),该过程属于 变化。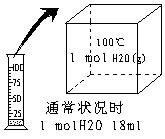
在保持压强不变的情况下,水蒸气的体积 
(填“>”、“<”或“=”)22.4L。
⑵乙同学做H2在O2中燃烧的实验,该实验过程属于 变化,在该变化过程中,一定保持相等的是 (填序号)。
| A.反应物分子数目与生成物分子数目 | B.反应物原子总物质的量与生成物原子总物质的量 |
| C.反应物总质量与生成物总质量 | D.反应物体积与生成物体积 |
 ③刻度线 ④浓度 ⑤容积
③刻度线 ④浓度 ⑤容积ClO2或Cl2的稀溶液可作为常用消毒剂,其中ClO2溶液的消毒效果较好。已知ClO2常温下呈气态,其分子构型与水分子的分子构型相似,在自然环境中ClO2最终变为Cl–。下列有关说法中正确的是 ( )![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() A.ClO2的分子结构呈V型,属非极性分子
A.ClO2的分子结构呈V型,属非极性分子
![]() B.常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3+2NaClO3+H2SO4
B.常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3+2NaClO3+H2SO4![]() 2Na2SO4+2ClO2↑+H2O
2Na2SO4+2ClO2↑+H2O
![]() C.ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害
C.ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害
![]() D.ClO2中氯元素是+4价,具有很强的氧化性,其消毒效率(以单位物质的量得电子的数目表示)是Cl2的5倍
D.ClO2中氯元素是+4价,具有很强的氧化性,其消毒效率(以单位物质的量得电子的数目表示)是Cl2的5倍
用“>”或“<”完成下列问题:
(1)酸性:H2CO3______H2SiO3,H2SiO3______H3PO4
(2)碱性:Ca(OH)2______Mg(OH)2,Mg(OH)2______Al(OH)3
(3)气态氢化物稳定性:H2O______H2S,H2S______HCl
(4)还原性:H2O______H2S,H2S______HCl
(5)酸性:H2SO4______H2SO3,HClO4______HClO
从以上答案中可以归纳出:
①元素的非金属性越强,其对应最高氧化物的水化物的酸性越_____;
②元素的金属性越强,其对应最高氧化物的水化物的碱性越_____;
③元素的性越强,其对应气态氢化物的稳定性越_____;
④非金属性越强的元素生成的气态氢化物,其还原性越_____;
⑤同种非金属元素形成的含氧酸,其成酸元素价态越高,其酸性也越_____。
(5分)用“>”或“<”填空:
(1)酸性:H2CO3___________H2SiO3,H2SiO3___________H3PO4。
(2)碱性:Ca(OH)2___________Ba(OH)2,Mg(OH)2___________Al(OH)3
(3)气态氢化物稳定性:NH3___________ H2O, H2S ___________ HCl
(4)还原性:HCl___________HBr,H2S___________HCl
(5)酸性:H2SO4___________H2SO3,HClO ___________ HClO4
(10分)用“√”或“×”判断下列说法是否正确。
(1)一个D2O分子所含的中子数为8。
(2)HI、HBr、HCl、HF的稳定性依次增强。
(3)同主族元素从上到下,单质的熔点逐渐降低。
(4)常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快。
(5)从能量角度看,断开化学键要放热,形成化学键要吸热。一个化学反应是释放能量,还是吸收能量,取决于二者的相对大小。
(6)将锌片和铜片用导线连接,并平行插入稀硫酸中,由于锌片是负极,所以溶液中的H+向负极迁移。
(7)在二氧化硫与氧气的反应中,适当提高氧气浓度,可提高二氧化硫的转化率。
(8)二氯甲烷没有同分异构体,证明甲烷分子具有正四面体结构。
(9)用点燃或通入酸性高锰酸钾溶液中的方法均可以鉴别甲烷和乙烯。
(10)苯不与酸性高锰酸钾溶液、溴水发生反应,证明苯不具有类似乙烯中的双键。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com