
题目列表(包括答案和解析)
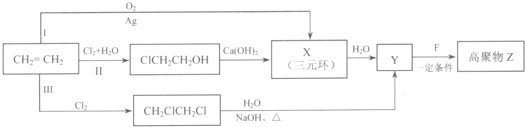
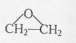

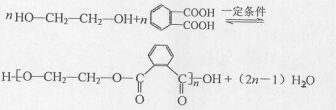

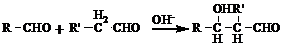 (R、R'代表烃基或氢原子)
(R、R'代表烃基或氢原子)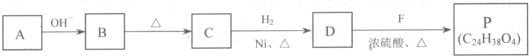
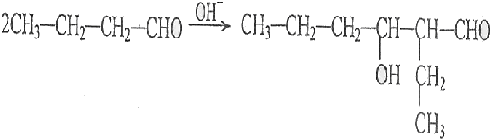
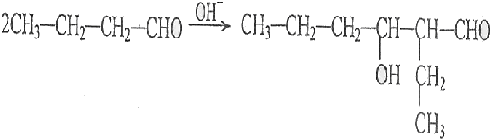
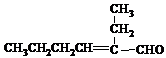
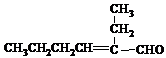

| 非晶体Co-B合金 |
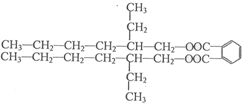
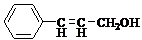 )的合成路线:
)的合成路线: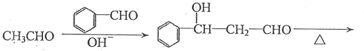
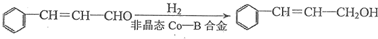

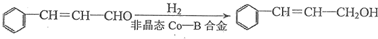
| 试剂1 |
| 条件1 |
| 试剂2 |
| 条件2 |
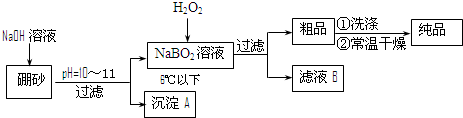
 硼是一种重要的非金属元素,单质硼可以通过硼镁矿Mg2B2O5?H2O来制取.
硼是一种重要的非金属元素,单质硼可以通过硼镁矿Mg2B2O5?H2O来制取. 金刚石是常见的原子晶体,若某块金刚石中有n个碳原子,则其中的共价键数目是
金刚石是常见的原子晶体,若某块金刚石中有n个碳原子,则其中的共价键数目是(10分)过硼酸钠是一种优良的漂白剂,被广泛应用于洗衣粉、漂白粉、洗涤剂中。以硼砂(主要成为Na2B4O7)为原料生产过硼酸钠晶体的主要流程如下:
(1)由Na2B4O7和NaOH反应制NaBO2的离子方程式为 ▲ ;
(2)沉淀A中含有酸不溶物和氢氧化镁杂质,为了分离出氢氧化镁,在沉淀中加过量的酸,过滤得到含Mg2+的滤液,再在滤液加入碱使Mg2+形成氢氧化镁。若加碱前溶液中c(Mg2+) =0.056 mol•L-1,那么需调节溶液的pH = ▲ 时,才开始出现沉淀。[已知25℃下Mg(OH)2的Ksp=5.6×10-12]
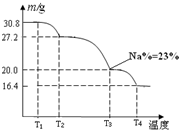
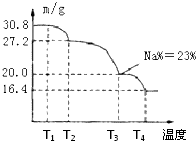
(3)已知纯品过硼酸钠晶体中各元素的物质的量比为:n(Na):n(B): n(H) :n(O)=1: 1: n: 7。将制得的纯品样品在70℃以上加热将逐步失去结晶水,测得纯品质量随温度的变化如图所示,则T3时所得晶体的化学式为___▲___。(书写简单计算过程)

(4)若反应温度控制不当,所得的过硼酸钠晶体中将混有NaBO2 ,则产品中钠的质量分数 ▲ (填 “升高”、“降低”或“不变”)。 [来源:ZXXK]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com