
题目列表(包括答案和解析)
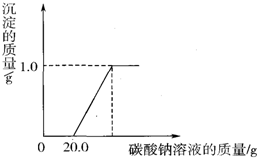 某研究性学习小组用石灰石(杂质不溶于水,不和盐酸反应)和稀盐酸制取二氧化碳
某研究性学习小组用石灰石(杂质不溶于水,不和盐酸反应)和稀盐酸制取二氧化碳| 操作 | 现象 | 结论 |
| 溶液中加入少量铁粉 | 有气泡冒出 | 猜想 三 三 成立 |
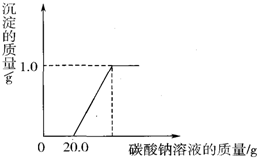 某研究性学习小组用石灰石(杂质不溶于水,不和盐酸反应)和稀盐酸制取二氧化碳
某研究性学习小组用石灰石(杂质不溶于水,不和盐酸反应)和稀盐酸制取二氧化碳| 操作 | 现象 | 结论 |
| 溶液中加入少量铁粉 | 有气泡冒出 | 猜想______成立 |
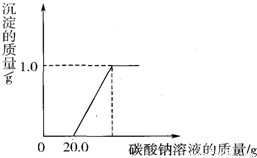
| 操作 | 现象 | 结论 |
| 溶液中加入少量铁粉 | 有气泡冒出 | 猜想______成立 |
| 操作 | 现象 | 结论 |
| 溶液中加入少量铁粉 | 有气泡冒出 | 猜想______成立 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com