以CO
2为碳源制取低碳有机物成为国际研究焦点,下面为CO
2加氢制取低碳醇的热力学数据:
反应I:CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)△H=-49.0 kJ?mol
-1反应II:2CO
2(g)+6H
2(g)?CH
3CH
2OH(g)+3H
2O(g)△H=-173.6kJ?mol
-1(1)写出由CH
3CH
2OH+
H2O
H2O
?2CH
3OH的热化学方程式为:
CH3CH2OH(g)+H2O(g)=2CH3OH(g);△H=+75.6 kJ?mol-1
CH3CH2OH(g)+H2O(g)=2CH3OH(g);△H=+75.6 kJ?mol-1
.
(2)在一定条件下,对于反应I:在体积恒定的密闭容器中,达到平衡的标志是
bf
bf
(填字母)
a.CO
2和CH
3OH 浓度相等 b.H
2O的百分含量保持不变
c.H
2的平均反应速率为0 d.v
正(CO
2)=3v
逆(H
2)
e.混合气体的密度不再发生改变 f.混合气体的平均相对分子质量不再发生改变
如果平衡常数K值变大,该反应
ad
ad
(填字母)
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
其他条件恒定,如果想提高CO
2的反应速率,可以采取的反应条件是
bd
bd
(填字母),达到平衡后,想提高H
2转化率的是
ac
ac
(填字母)
a、降低温度 b、补充H
2 c、移去甲醇 d、加入催化剂
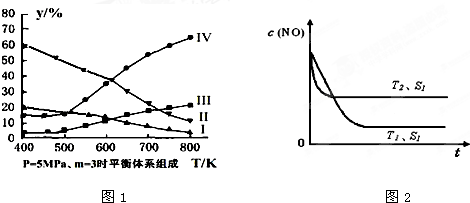
(3)在密闭容器中,对于反应II中,研究员以生产乙醇为研究对象,在5MPa、m=n(H
2)/n(CO
2)=3时,测得不同温度下平衡体系中各种物质的体积分数(y%)如图1所示,则表示CH
3CH
2OH体积分数曲线的是
Ⅰ
Ⅰ
;表示CO
2的体积分数曲线的是
Ⅲ
Ⅲ
.
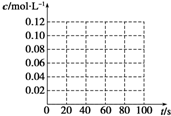
(4)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图2是反应:2NO(g)+2CO(g)?2CO
2(g)+N
2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,若催化剂的表面积S
1>S
2,在图2中画出NO的浓度在T
1、S
2条件下达到平衡过程中的变化曲线,并注明条件.

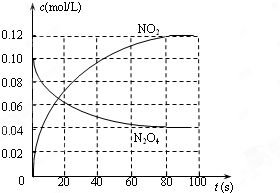
 在100℃时,将0.40mol的二氧化氮气体充入2L真空的密闭容器中,每隔一段时间就对该容器内的物质进行分析,得到数据如表所示:
在100℃时,将0.40mol的二氧化氮气体充入2L真空的密闭容器中,每隔一段时间就对该容器内的物质进行分析,得到数据如表所示: 2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据: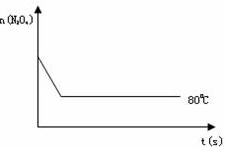
 在100℃时,将0.40mol二氧化氮气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
在100℃时,将0.40mol二氧化氮气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据: