
题目列表(包括答案和解析)
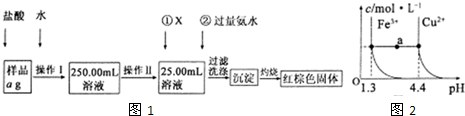
 (12分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
(12分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
请根据上面流程,回答以下问题:
(1)操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 ▲
、 ▲ .(填仪器名称)
(2)下列操作可能使所配溶液浓度偏小的是________▲________(填写序号)。
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,www..com发现液面低于刻度线后继续加水至凹液面与刻度线相切
(3)请写出加入氯水发生的离子反应方程式 ▲ ,
(4)检验沉淀是否已经洗涤干净的操作是 ▲ 。
(5)若原样品质量a为10g,加热后红棕色固体质量是6g,则样品中铁元素的质量分数是 ▲ ;
10(W2-W1)×
| ||
| a |
10(W2-W1)×
| ||
| a |
(14分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行: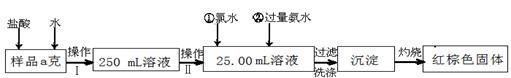
请根据上面流程,回答以下问题:
(1)操作I 所用到的玻璃仪器除烧杯、玻璃棒、量筒外,还必须有 (填自选仪器名称),操作II 必须用到的仪器是 (从以下选项中选择,填编号)。
| A.50mL烧杯 | B.50mL量筒 | C.25mL碱式滴定管 | D.25mL酸式滴定管 |
(14分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
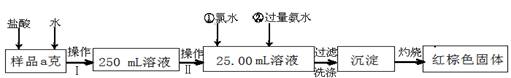
请根据上面流程,回答以下问题:
(1)操作 I 所用到的玻璃仪器除烧杯、玻璃棒、量筒外,还必须有 (填自选仪器名称),操作 II 必须用到的仪器是 (从以下选项中选择,填编号)。
A.50mL烧杯 B.50mL量筒 C.25mL碱式滴定管 D.25mL酸式滴定管
(2)加入试剂①和②后发生反应的离子反应方程式为:
(3) 将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3 g,则接下来还应进行的操作是____________。
(4) 若坩埚质量是W1g,坩埚与加热后固体总质量是W2g,则样品中铁元素的质量分数是: 。
(5) 有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的。他的理由是:
(用化学方程式表示)
(14分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
请根据上面流程,回答以下问题:
(1)操作 I 所用到的玻璃仪器除烧杯、玻璃棒、量筒外,还必须有 (填自选仪器名称),操作 II 必须用到的仪器是 (从以下选项中选择,填编号)。
A.50mL烧杯 B.50mL量筒 C.25mL碱式滴定管 D.25mL酸式滴定管
(2)加入试剂①和②后发生反应的离子反应方程式为:
(3) 将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3 g,则接下来还应进行的操作是____________。
(4) 若坩埚质量是W1g,坩埚与加热后固体总质量是W2g,则样品中铁元素的质量分数是: 。
(5) 有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的。他的理由是:
(用化学方程式表示)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com