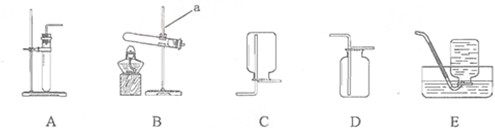
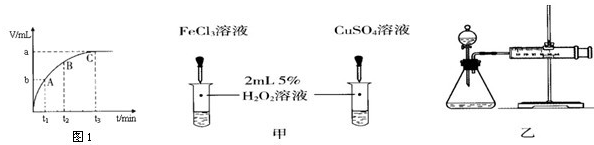
实验室常用下列装置制取气体,请你根据所学知识回答下列问题.
(1)写出编号所指仪器的名称:①
长颈漏斗
长颈漏斗
;②
集气瓶
集气瓶
.
(2)以上装置图中共有两处明显的错误,请你找出错误的地方并把改正的结果填在下列横线上:①
错误:试管口向上倾斜,改正:试管口稍向下倾斜.
错误:试管口向上倾斜,改正:试管口稍向下倾斜.
;②
错误:向上排空气法收集气体的导管未伸入到接近瓶底,改正:向上排空气法收集气体的导管应伸入到接近瓶底.
错误:向上排空气法收集气体的导管未伸入到接近瓶底,改正:向上排空气法收集气体的导管应伸入到接近瓶底.
.
上述装置改进后,请继续回答下列问题.
(3)你和小明一起进行实验室制取二氧化碳的探究.
①选择药品.小明对三组药品进行了研究,实验记录如下:
| 组别 |
药品 |
实验现象 |
| ① |
块状石灰石和稀盐酸 |
产生气泡速率适中 |
| ② |
块状石灰石和稀硫酸 |
产生气泡速率缓慢并逐渐停止 |
| ③ |
碳酸钠粉末和稀盐酸 |
产生气泡速率很快 |
从制取和收集的角度分析,一般选择第①组药品,该组药品发生反应的文字表达式为
碳酸钙+盐酸→氯化钙+二氧化碳+水
碳酸钙+盐酸→氯化钙+二氧化碳+水
;
不选择第③组药品的原因是
产生气体速率很快,不易收集
产生气体速率很快,不易收集
.
②选择装置.通过对制取气体装置的分析,他选择用B或者C的发生装置.你认为他选择的依据是
固液常温下反应制取气体
固液常温下反应制取气体
.比较这两个装置的不同,指出B装置的一个突出优点
可以控制反应的发生和停止
可以控制反应的发生和停止
.
③制取气体.将药品装入所选装置制取气体,并用装置E来收集二氧化碳气体,验满方法是
将燃着的木条伸入瓶口处,若木条熄灭,则证明收集满了
将燃着的木条伸入瓶口处,若木条熄灭,则证明收集满了
.
有一名同学欲用G来代替E,则气体应从导管口
a
a
通入.
(4)小亮发现:收集的氧气占集气瓶容积的60%(空气占40%)时,能使带火星的木条复燃.那么,使带火星的木条复燃的氧气浓度的最低值是多少呢?小亮对此展开探究:
第一组实验:取5只集气瓶,编号为①、②、③、④、⑤,按要求收集气体.将带火星的木条依次插入①~⑤号瓶中,记录实验现象.
小亮在前一组实验的基础上又做了第二、三组实验,三组实验的数据和现象见表.
|
第一组 |
第二组 |
第三组 |
| 集气瓶编号 |
① |
② |
③ |
④ |
⑤ |
① |
② |
③ |
④ |
⑤ |
① |
| 收集的O2占容积的体积分数(%) |
l0 |
20 |
30 |
40 |
50 |
3l |
33 |
35 |
37 |
39 |
34 |
| 带火星木条的状况 |
微亮 |
亮 |
很亮 |
复燃 |
复燃 |
很亮 |
很亮 |
复燃 |
复燃 |
复燃 |
很亮 |
请根据实验回答下列问题:
①为了达到实验目的必须用排水法收集氧气.请你帮小亮选出制取氧气的发生和收集装置
B
B
,写出制取氧气的化学反应文字表达式
.若用G来代替收集装置,则气体应从导管口
a
a
通入.
②使用带火星的木条验满氧气的方法是否可靠:
否
否
(填“是”或“否”).
③集气瓶中氧气的体积分数=收集的氧气占容积的体积分数+瓶中空气占容积的体积分数×
21
21
%.
④收集的氧气占容积的体积分数最低为
35
35
%时,可使带火星的木条复燃,这时集气瓶中氧气分数是
49
49
%(计算结果保留整数).
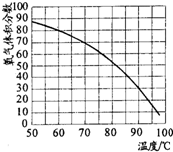
⑤用带火星的木条直接检验双氧水受热分解产生的氧气时,往往难以复燃,这是因为在加热生成氧气的同时产生大量水蒸汽所致,此时混合气体中氧气的体积分数随温度变化的曲线如下图所示.若只考虑氧气的体积分数对实验结果的影响,欲使带火星的木条复燃,应将加热双氧水的最高温度控制在
82
82
℃.
⑥采取“半值法”探究能减少实验次数.例如:第一组实验若按③、④的编号顺序进行实验,即可确定下一组实验收集的氧气占容积的体积分数应在30%~40%之间,从而省去编号为①、②、⑤的实验.同理,第二组实验可以省去的实验编号为
①、④、⑤
①、④、⑤
.