3月22日是“世界水日”,2011年“世界水日”的宣传主题为:“城市用水:应对都市化挑战”.水与人类的生活和生产密切相关.请回答以下相关问题:
(一)水--常用的化学试剂
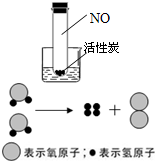
(1)为验证活性炭的吸附能力和温度的关系,某同学将底部装有活性炭颗粒、充满红棕色NO
2气体(有毒气体)的试管插入盛有水的烧杯中(如图),然后向烧杯中加入NH
4NO
3,观察到试管中红棕色慢慢变淡至褪色,说明
温度越低,活性炭的吸附能力越好
温度越低,活性炭的吸附能力越好
;
(2)电解水时,需在水中加入少量氢氧化钠或硫酸,目的是
为了增强水的导电性
为了增强水的导电性
,如图是实验室电解水的微观示意图,其中最小的微粒是
原子
原子
,通过该实验可以得出的结论是
水是由氢元素和氧元素组成的
水是由氢元素和氧元素组成的
.
(二)海水--人类的资源宝库
(1)获取淡水:将海水转化为淡水,最常用的操作方法是
蒸馏法
蒸馏法
;
(2)获取NaCl:将海水进行
蒸发
蒸发
可得到粗盐;为除去粗盐中含有的Na
2SO
4、CaCl
2等杂质,可依次进行下列操作:①溶解;②加过量的BaCl
2溶液; ③加过量的Na
2CO
3溶液;④过滤;⑤加适量的X溶液;⑥蒸发结晶.其中适量X溶液是
稀盐酸
稀盐酸
(填名称);
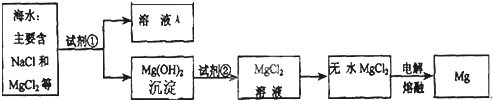
(3)提取金属镁:海水中含有丰富的镁元素,如图是从海水中提取镁的简单流程:

上述流程中,沉淀B是Mg(OH)
2,则试剂A可以用
氢氧化钙
氢氧化钙
溶液,试剂C的化学式为
HCl
HCl
,由无水MgCl
2制取Mg的化学方程式为
,属于
分解
分解
反应.
(三)清洁卫生的水--人类需要
(1)保护运河,我提建议:①生活污水处理后排放;②将工厂废液排入运河;③使用无磷洗衣粉,④减少燃放烟花爆竹 ⑤及时清理运河中疯长的藻类.你认为以上建议中可以采纳的是
①③④⑤
①③④⑤
(填序号);
(2)以下是污水处理成自来水的工艺流程示意图:
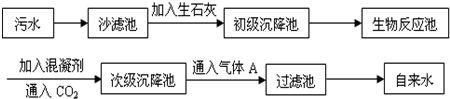
①污水中含Ca
2+、Mg
2+、HCO
3-等,加入生石灰后生成Ca(OH)
2,进而发生若干复分解反应,初级沉降池中生成的主要沉淀是
碳酸钙
碳酸钙
和
碳酸镁
碳酸镁
;(MgCO
3微溶于水)
②通入CO
2除了能调节自来水的pH,还能
除去过量的氢氧化钙
除去过量的氢氧化钙
;
③生物反应池是利用微生物直接分解水中的有机物,以除去水中过多的氮、磷等有害成分.这样做的优点是
不会产生污染,比较环保
不会产生污染,比较环保
;
④工艺中的混凝剂常用
明矾
明矾
,其除去悬浮固体小颗粒的过程
A
A
;(填编号)
A.只是物理过程 B.只是化学过程 C.是物理和化学过程
⑤气体A是
Cl2
Cl2
(填化学式),其作用是杀菌消毒,使自来水符合卫生标准;
⑥俗话说:“大灾之后必有大疫”,这主要是因为灾民饮用了含有大量的细菌和杂质的水后,很容易患肠道传染病.请你设计合理方案,将被污染的水处理成能饮用的水:
加入明矾净水、然后过滤、用氯气杀菌消毒、最后加热煮沸
加入明矾净水、然后过滤、用氯气杀菌消毒、最后加热煮沸
.


 3月22日是“世界水日”,2011年“世界水日”的宣传主题为:“城市用水:应对都市化挑战”.水与人类的生活和生产密切相关.请回答以下相关问题:
3月22日是“世界水日”,2011年“世界水日”的宣传主题为:“城市用水:应对都市化挑战”.水与人类的生活和生产密切相关.请回答以下相关问题: