
题目列表(包括答案和解析)
MnO2+![]() +4H+====Mn2++2CO2↑+2H2O
+4H+====Mn2++2CO2↑+2H2O
2![]() +5
+5![]() +16H+====2Mn2++10CO2↑+8H2O
+16H+====2Mn2++10CO2↑+8H2O
通过如下实验测定软锰矿中MnO2的质量分数。
①准确称取软锰矿样品m g于烧杯中,加入过量草酸钠(Na2C2O4)和足量的稀硫酸,加热至反应完全(杂质不参加反应);
②冷却、过滤、洗涤,洗涤液及滤液全部转移至500 mL容量瓶并定容;
③从容量瓶中取出25.00 mL溶液于锥形瓶中,以0.0200 mol·L-1的KMnO4标准溶液滴定,当滴入20.00 mL KMnO4溶液时达滴定终点。
请回答下列问题:
(1)实验步骤①中草酸钠必须加入过量的目的是__________________________________。
(2)实验步骤②中若未将洗涤液(含洗涤滤出物、盛滤液的烧杯及玻棒)全部转移入容量瓶,将导致测量结果____________。(填“偏高”“偏低”或“无影响”)
(3)实验步骤③中KMnO4标准溶液应置于____________(填“酸式”或“碱式”)滴定管中。判断达到滴定终点的现象是__________________________________________。
(4)欲实现本实验的目的,实验中还应准确获得的数据是____________。请用设定的物理量结合测定的数据表示出该软锰矿中MnO2的质量分数:____________。
(5)完成本实验的化学原理有多种。例如:
①4MnO2![]() 2Mn2O3+O2↑;
2Mn2O3+O2↑;
②3MnO2+4Al![]() 3Mn+2Al2O3;
3Mn+2Al2O3;
③MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
试从化学实验方案设计的科学性、简约性等评估,上述原理中适宜的是__________(填序号)。
| ||
| ||
A.发展循环经济,构建资源节约型社会及清洁生产技术
B.采用绿色化学生产工艺,建立环境友好型化工体系
C.大力开发可再生资源,推广用乙醇汽油代替传统的燃油
D.设计化学实验方案时,提倡用尽可能多的样品和试剂以提高实验效果
Ⅰ.用如下化学实验方案的设计及要求—性质、制备和检验图所示装置进行Mg与SO2反应的实验。
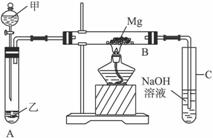
(1)选择制取SO2的合适试剂____________________________________________。
①10%的H2SO4溶液 ②98%的H2SO4溶液 ③Na2SO3固体 ④CaSO3固体 ⑤Cu
(2)写出装置B中发生的主要反应的化学方程式___________________________________,
装置C中NaOH溶液的作用是_______________________________________________。
(3)你认为该装置是否有不足之处?________________________________,如果有,请一一说明____________________________________________________________。
Ⅱ.某研究小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的信息:
①工业上在高温时用C还原SiO2可制得Si ②Mg在点燃的条件下即可与SiO2反应 ③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4 ④Si和SiO2均不与稀H2SO4反应 ⑤SiH4在空气中自燃
他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(4)该小组“实验室制Si”的化学方程式是_________________________________________。
(5)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是_________________
____________________________________________________________________。
A.发展循环经济,构建资源节约型社会及清洁生产技术
B.采用绿色化学生产工艺,建立环境友好型化工体系
C.大力开发可再生资源,推广用乙醇汽油代替传统的燃油
D.设计化学实验方案时,提倡用尽可能多的样品和试剂以提高实验效果
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com